
(I)在一定条件下,发生反应:
 aA(g) +bB(g) cC(g) △H=Q kJ/mol,其化学平衡常数K和温度的关系如下表所示:
aA(g) +bB(g) cC(g) △H=Q kJ/mol,其化学平衡常数K和温度的关系如下表所示:

依据图表判断该反应△H 0(填“>”或“<”):若其它条件保持一定,降低温度,该反应物A的转
化率 (填“增大”、“减小”或“不变”下同),化学反应速率将 。
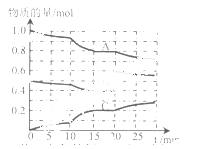
 (II)在恒定温度t℃,2L恒容密闭容器中发生反应aA(g) +bB(g) cC(g),容器中A、B、C物质的量
(II)在恒定温度t℃,2L恒容密闭容器中发生反应aA(g) +bB(g) cC(g),容器中A、B、C物质的量
变化如图所示,回答下列问题:
该化学方程式中a:b:c为 ,t℃时该反应的化学平衡常数K的值为____ 。(保留2位小数)
(2) 0~15 min内,B的平均反应速率为 ,反应达平衡时,A的转化率为 。
(3)据图判断,反应进行至20 min时,曲线发生变化的原因是 (用文字表达),反应重新达平衡时,A的体积分数将 (填“增大”、“减小”或“不变”)。
(4) 10 min到15 min的曲线变化的原因可能是 。
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数。下列说法正确的是( )
A.标准状况下,11.2L乙烯含有的极性共价键数为NA
B.常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA
C.16.9gBaO2固体中阴、阳离子总数为0.2NA
D.含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列说法正确的是( )
A. 1L 0.1mol/L的Na2CO3溶液中,含Na+0.2 NA个,CO32-0.1 NA个
B. 1L 0.3mol/L的K2SO4溶液中,含K+和SO42-离子总数为0.9 NA个
C. 2L 0.6mol/L的Fe2(SO4)3溶液中,含SO42-离子总数为2.4 NA个
D. 0.1mol/L的H3PO4溶液中,c(H+)∶c(PO43-)<3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B两种 气体在一定条件发生反应:
气体在一定条件发生反应:
aA(g)+bB(g)cC(g)+dD(g)
取a mol A和b mol B置于容积为V L的容器内,1 min后,测得容器中A的浓度为x mol·L-1。则此时B的浓度为________,C的浓度为________,以A的浓度变化表示的反应速率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示。下列叙述中正确的是 ( )
A.反应的化学方程式为5YX
B.t1时,Y的浓度是X浓度的1.5倍
C.t2时,正、逆反应速率相等
D.t3时,逆反应速率大于正反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
2SO2(g)+O2(g)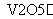 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均反应速率为v=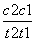
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中错误的是 ( )
A.从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L
B.制成0.5 L 10 mol/L的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol/L BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 g/cm3)与10 mL 18.4 mol/L硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学用Na2CO3配制0.10 mol/L的Na2CO3溶液的过程如图所示:
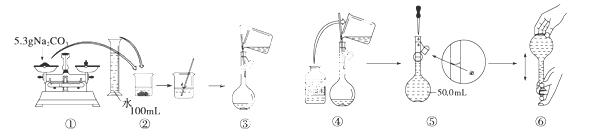
你认为该同学的错误步骤有 ( )
A.1处 B.2处 C.3处 D.4处
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气净化中的一个反应如下:
NO(g)+CO(g) 
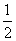 N2(g)+CO2(g)
N2(g)+CO2(g)
ΔH=-3 73.4 kJ·mol-1
73.4 kJ·mol-1
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( )

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com