
| A. | 1:2 | B. | 2:1 | C. | 1:3 | D. | 1:1 |
分析 向含Fe2(SO4)3、CuCl2、H2SO4的混合溶液中投入足量的Fe粉,充分反应,发生反应Fe+CuCl2=Cu+FeCl2,Fe+Fe2(SO4)3=3FeSO4,Fe+H2SO4=FeSO4+H2↑,
反应前固体为铁,设其物质的量为x,反应后只有铜,设其物质的量为y,依据质量关系列式得到(1)56x-64y=16g,
由于氧化还原反应过程中存在电子守恒,铁总共失去电子数2x,铜离子得到2y个电子,剩下的电子最终都是在二价铁离子中,可知溶液最后的二价铁离子的量$\frac{2x-2y}{2}$+x=2x-y,而已知反应后二甲铁离子与反应前铜离子的比例为3:1,(2)(2x-y):y=3:1,
联立(1)(2)计算得到y=$\frac{1}{3}$,2x-y=1,结合元素守恒计算.
解答 解:反应前固体为铁,设其物质的量为x,反应后只有铜,设其物质的量为y,
依据质量关系列式得到(1)56x-64y=16g,
由于氧化还原反应过程中存在电子守恒,铁总共失去电子数2x,铜离子得到2y个电子,剩下的电子最终都是在二价铁离子中,可知溶液最后的二价铁离子的量$\frac{2x-2y}{2}$+x=2x-y,
而已知反应后二甲铁离子与反应前铜离子的比例为3:1,(2)(2x-y):y=3:1,
联立(1)56x+64y=16g
(2)(2x-y):y=3:1
计算得到y=$\frac{1}{3}$,2x-y=1,
由氯化铜中元素守恒和氯元素的量为2y=$\frac{2}{3}$,
电荷守恒可知硫酸根离子物质的量[2(x-y)×2-$\frac{2}{3}$]×$\frac{1}{2}$=$\frac{2}{3}$,
硫酸根离子和氯离子物质的量之比为1:1,
故选D
点评 本题考查了物质性质、氧化还原反应顺序、元素守恒、电子守恒的计算应用,题目难度较大.


科目:高中化学 来源: 题型:解答题
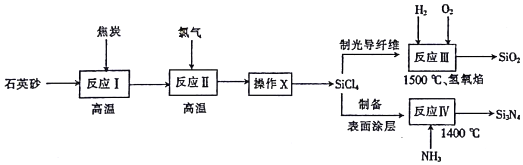
| 组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
| 质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
| 沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
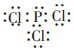 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Mg | C. | A1 | D. | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 移走少量C | B. | 扩大容积,减小压强 | ||
| C. | 缩小容积,增大压强 | D. | 容积不变,充入“惰”气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
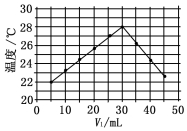 将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A. | 做该实验时环境温度为22℃ | |
| B. | 该实验表明可将热能转化为化学能 | |
| C. | NaOH溶液的浓度约为1.5 mol•L-1 | |
| D. | 该实验表明有水生成的反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

压强 温度℃ | 0.2Mpa | 1.0Mp | 10Mpa |
| 400 | 97.2% | 99.5% | 99.7% |
| 500 | 91.5% | 96.9% | 97.8% |
| 600 | 72.6% | 85.8% | 89.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据对角线规则,铍和铝的性质具有相似性 | |
| B. | 在H3O+、NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | O3与SO2的结构相似 | |
| D. | P4和CH4都是正四面体分子且键角都为109°28ˊ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验内容 | 实验目的 |
| A | 用注射器收集铜与浓硝酸反应生成的气体,然后推拉注射器 | 研究压强对化学平衡移动的影响 |
| B | 在实验室制得的乙酸乙酯中加入饱和碳酸钠溶液,然后蒸馏 | 除去乙酸乙酯中混有的乙酸、乙醇 |
| C | 用饱和FeCl3溶液制得Fe(OH)3胶体,然后过滤 | 提纯Fe (OH)3胶体 |
| D | 往混有FeCl2的CuCl2溶液中加人H2O2后,用氨水调节pH 至2.7 后过滤 | 除去CuCl2溶液中FeCl2杂质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com