
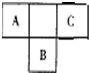
 短周期元素的A、B、C在元素周期表中的位置如右图所示,已知A、C 两种元素的原子核外电子数之和等于B的质子数,B原子核内质子数和中子数相等.据此填空:
短周期元素的A、B、C在元素周期表中的位置如右图所示,已知A、C 两种元素的原子核外电子数之和等于B的质子数,B原子核内质子数和中子数相等.据此填空: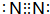 ,故答案为:N2;
,故答案为:N2;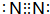 ;
;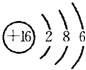 ,在周期表中位于第三周期第ⅥA族,
,在周期表中位于第三周期第ⅥA族, ;第三周期第ⅥA族;
;第三周期第ⅥA族;

 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
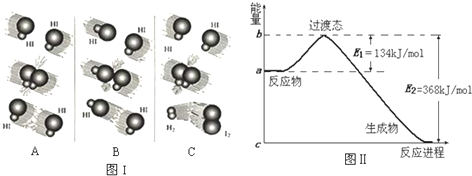
| 化学键 | C-H | Cl-Cl | C-Cl | H-Cl |
| 键能/kJ?mol-1 | X | 243 | 330 | 432 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
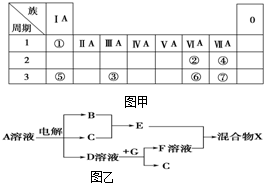 如图甲为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
如图甲为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
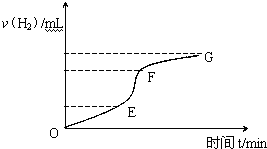 用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下pH为5的盐酸溶液稀释1000倍后,pH等于8 |
| B、浓度均为0.1mol/L的氨水和氯化铵溶液,水电离出的c(H+)前者小于后者 |
| C、碳酸钠溶液中存在:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) |
| D、等浓度的CH3COOH与KOH以任意比混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com