
【题目】某小组利用氯酸钾与10 mol·L-1盐酸反应制氯气并进行氯气性质的探究,实验装置如图所示:

请回答:
(1)装置F的名称是____________。
(2)E中实验现象是___________。
(3)根据相关实验现象就可以证明起漂白作用的不是氯气而是次氯酸,相关现象是_________。
(4)现要配制240mL 10 mol·Lˉ1所需盐酸,请回答下列问题:
①所用的仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要的仪器是_________。
②配制好的盐酸放入试剂瓶中后,需要贴上标签,请你在图标签上填好所配溶液的信息_________。

③配制过程中有下列实验操作步骤,其正确的顺序为___________________。
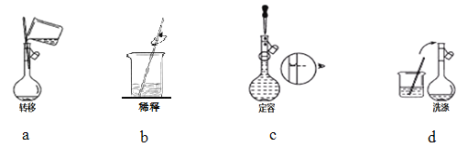
④下列操作会使配制结果偏高的是__________________。
A.容量瓶洗净后未干燥直接用来配制溶液
B.反复摇匀后发现液面低于刻度线,继续加水至刻度线
C.定容时俯视读数
D.用量筒量取浓盐酸配制所需盐酸时,量筒仰视读数
【答案】(球形)干燥管 产生棕黄色的烟 A中紫色石蕊试液先变红后褪色,D中干燥红布条不褪色 250mL容量瓶  b a d c CD
b a d c CD
【解析】
氯酸钾与10 mol·Lˉ1盐酸反应会生成氯气,A中紫色石蕊试液遇氯气会先变红后褪色,经过干燥剂C干燥后遇到干燥的红布条,红布条不褪色,结合A中现象,说明干燥的氯气不具有漂白性;E装置中铜粉与干燥的氯气在加热条件下会反应生成氯化铜,氯气有毒,需用碱液进行尾气处理,据此分析第(1)-(3)问;
(4)①根据配制一定浓度溶液的操作与步骤分析所需实验仪器;
②根据实验室的规范操作要求作答;
③根据配制一定浓度盐酸溶液的操作与步骤分析;
④依据c=![]() 分析误差对测定结果带来的影响。
分析误差对测定结果带来的影响。
根据上述分析可知,
(1)装置F的名称是(球形)干燥管;
(2)E中铜粉与氯气在加热条件下反应生成氯化铜,产生棕黄色的烟,故答案为:产生棕黄色的烟;
(3)根据实验目的可知,A中紫色石蕊试液先变红后褪色,D中干燥红布条不褪色,则说明起漂白作用的不是氯气而是次氯酸,故答案为:A中紫色石蕊试液先变红后褪色,D中干燥红布条不褪色;
(4)①实验室没有240mL规格的容量瓶,因此要配制240mL 10 mol·Lˉ1所需盐酸除需量筒、烧杯、玻璃棒、胶头滴管外,还需要的仪器是250mL容量瓶;
②标签上需注明溶液名称与物质的量浓度,故答案为: ;
;
③浓盐酸稀释为稀盐酸其步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,根据图示信息可知,正确的顺序为b a d c;
④A.容量瓶洗净后未干燥直接用来配制溶液,对测定结果无影响,不符合题意,A项错误;
B.反复摇匀后发现液面低于刻度线,继续加水至刻度线,相当于稀释溶液,导致最终结果偏低,不符合题意,B项错误;
C.定容时俯视读数,则所测溶液的体积偏小,根据c=![]() 可知,最终配制结果偏高,符合题意,C项正确;
可知,最终配制结果偏高,符合题意,C项正确;
D.用量筒量取浓盐酸配制所需盐酸时,量筒仰视读数,所量浓盐酸的物质的量偏大,根据c=![]() 可知,最终配制结果偏高,符合题意,D项正确,故答案为:CD。
可知,最终配制结果偏高,符合题意,D项正确,故答案为:CD。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示.已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是

A. x的数值为![]()
B. c点时有![]() 生成
生成
C. 加入蒸馏水可使溶液由d点变成a点
D. b点与d点对应的溶度积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期过渡元素如铁、锰、铜、锌等在太阳能电池、磁性材料等科技方面有广泛的应用,回答下列问题:
(1)Fe的基态原子共有____种不同能级的电子。
(2)已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___。比较铁与锰的第三电离能(I3):铁__锰(填“>”、 “=”或“<”),原因是___。
(3)某含铜化合物的离子结构如图所示。

①该离子中存在的作用力有______________;
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
②该离子中N原子的杂化类型有____________。
(4)如图是晶体Fe3O4的晶胞,该晶体是一种磁性材料,能导电。
①晶胞中二价铁离子处于氧离子围成的______(填空间结构)空隙。
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为________。
③解释Fe3O4晶体能导电的原因__________;若晶胞的体对角线长为anm,则 Fe3O4 晶体的密度为______g·cm-3(阿伏加德罗常数用NA表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】菱锰矿的主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素。氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:

已知:①相关金属离子[c0(Mn+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
②常温下,CaF2、MgF2的溶度积常数分别为1.46×10-10、 7.42×10-11
回答下列问题:
(1) “焙烧”时发生的主要反应的化学方程式为__________。气体X为________(填化学式),写出它生活中的一种用途_______________。
(2)焙烧时温度对锰浸出率的影响如图所示。焙烧时适应温度为_______________。

(3)浸出液“净化除杂”过程如下:首先用MnO2将Fe2+氧化为Fe3+,再调节溶液的pH将Al3+、Fe3+变成沉淀除去,溶液的pH的范围为____然后加入NH4F将Ca2+、Mg2+转化为CaF2、MgF2沉淀除去,两种沉淀共存时,溶液中![]() =________(所得结果保留两位小数)。
=________(所得结果保留两位小数)。
(4)碳化结晶的原理(用离子方程式表示): ______________________。
(5)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,在某极得到重要的无机功能材料MnO2,该电极的电极反应式为_________。
(6)在该工艺流程中可以循环使用的物质有__________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A. 制乙酸乙酯时,将乙醇注入浓硫酸中,冷却后加入乙酸
B. 向溴乙烷中滴加硝酸酸化的AgNO3溶液,以检验其中的溴元素
C. 用氢氧化钠溶液清洗盛过苯酚的试管
D. 在试管中加入2mL2%的CuSO4溶液,然后加入4至6滴10%的NaOH溶液振荡、再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H可用于制备树脂、塑料和涂料等。其合成路线如下图所示:

已知:R—CH=CH2![]() RCH2CH2OH(其中B2H6为乙硼烷)
RCH2CH2OH(其中B2H6为乙硼烷)
请回答下列问题:
(1) 11.2 L(标准状况)的烃A在氧气中充分燃烧可以生成88 g CO2和45 g H2O。A的分子式是____________________。
(2)B和C在氢氧化钠的醇溶液中加热得到的有机物只有一种结构。B和C均为一氯代烃,它们的名称(系统命名)分别为_____________、_____________。
(3)在催化剂存在下1 mol F与2 mol H2反应,生成2甲基1丙醇。F的结构简式是_________________。其含有的官能团名称是_______________________。
(4)B→D,C→D的反应类型均为___________。请任写一个化学方程式_________________。
(5)写出F→G的化学方程式______________________________________________。
(6)写出E+G→H的化学方程式___________________________________________。
(7)写出与G具有相同官能团的G的所有同分异构体的结构简式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是空间立体网状结构,如图所示:
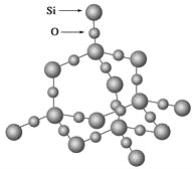
关于二氧化硅晶体的下列说法中,正确的是( )
A. 1 mol SiO2晶体中Si—O键为2 mol
B. 二氧化硅晶体的分子式是SiO2
C. 晶体中Si、O原子最外电子层都满足8电子结构
D. 晶体中最小环上的原子数为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,正确的是( )
A. 稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B. 稀硫酸与Ba(OH)2溶液混合:SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C. 稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3
D. 氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)室温下,在25 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,曲线如下图所示,回答下列问题:

(1)写出CH3COOH的电离方程式__________________________。
(2)下列说法不正确的是___________________。
A. 0.1 mol/L CH3COOH溶液中, CH3COOH电离度约为1%
B. B点满足: c(CH3COO-)-c(CH3COOH)=2c(OH-)-2c(H+)
C. C点时的离子浓度关系为:c(CH3COO-)= c(Na+)> c(H+)= c(OH-)
D. D点时的离子浓度关系为: c(Na+)> c(CH3COO-)> c(OH-)> c(H+)
(3)室温下,试计算CH3COOH电离平衡常数为____________(用含b的表达式表示)。
(二)实验室为测定食醋中CH3COOH的浓度,取25mL食醋置于250mL容量瓶中,加水稀释至刻度并摇匀。用酸式滴定管量取25.00mL稀释后的醋酸溶液放入锥形瓶中,加指示剂,然后用0.1000 mol·L-1NaOH标准溶液进行滴定。
(4)指示剂应为________。
A.甲基橙 B.甲基红 C.酚酞 D.石蕊
(5)滴定终点的判断方法为____________________________________________________。
(6)为提高测定的准确度,重复上述实验三次,0.1000 mol·L-1NaOH标准溶液滴定前后的读数如下表所示,则该食醋中CH3COOH的浓度为_________mol·L-1。
实验次数 | 稀释后的醋酸溶液体积/ mL | NaOH滴定前读数/ mL | NaOH滴定后读数/ mL |
第1次 | 25.00 | 0.10 | 24.00 |
第2次 | 25.00 | 0.50 | 22.50 |
第3次 | 25.00 | 0.20 | 24.30 |
(7)用0.1000 mol·L-1NaOH标准溶液进行滴定,下列操作会导致测定结果偏高的是_______。
A.碱式滴定管内滴定后产生气泡
B.读取标准液读数时,滴定前俯视,滴定到终点后仰视
C.配制0.1000 mol·L-1NaOH溶液时,固体NaOH中含有结晶水
D.碱式滴定管未润洗就装入标准液进行滴定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com