
 Fe2+、Fe3+与O22-、CN-、F-、有机分子等形成的化合物具有广泛的应用.
Fe2+、Fe3+与O22-、CN-、F-、有机分子等形成的化合物具有广泛的应用.| 1 |
| 4 |
| 1 |
| 8 |


科目:高中化学 来源: 题型:
| A、原溶液中肯定不含Mg2+、SiO32- |
| B、步骤Ⅱ中无色气体可能含有CO2,原溶液中可能含有CO32- |
| C、原溶液由K+、Fe2+、NO3-、I-、SO42-五种离子组成 |
| D、原溶液中一定含有Mg2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 | 甲 | 乙 | 丙 |
| A | H2SO4 | NH4HCO3 | Ba(OH)2 |
| B | H2S | NaOH | SO2 |
| C | NH3 | NO2 | HNO3 |
| D | FeBr3 | Cl2 | Cu |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向20mL 0.1mol?L-1氨水中逐滴加入0.1mol?L-1稀HCl,混合液pH与所加盐酸体积(V/mL)的关系如图所示.下列说法正确的是( )
向20mL 0.1mol?L-1氨水中逐滴加入0.1mol?L-1稀HCl,混合液pH与所加盐酸体积(V/mL)的关系如图所示.下列说法正确的是( )| A、在D点:c(NH4+)+c(NH3?H2O)>c(Cl-) | ||||
| B、在C点,有V1>10,且c(NH4+)c(Cl-)>c(OH-)=c(H+) | ||||
| C、在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||||
D、由B到C的过程中,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.| n(H2) |
| n(CO2) |
2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 装置用于分离CCl4和H2O的混合物 |
B、 装置用于收集H2、CO2、Cl2等气体 |
C、 装置用于吸收NH3或HCl,并防止倒吸 |
D、 装置用于收集NH3,并吸收多余的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
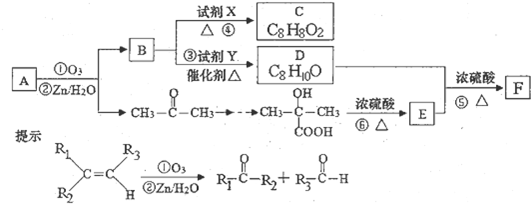
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子的浓度变化如图所示,(注:第一次平衡时c(I-)=2×10-3mol/L,c(Pb2+)=2×10-3mol/L)下列有关说法正确的是( )
常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子的浓度变化如图所示,(注:第一次平衡时c(I-)=2×10-3mol/L,c(Pb2+)=2×10-3mol/L)下列有关说法正确的是( )| A、常温下,Ksp=2×10-6 |
| B、温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,c(Pb2+)不变 |
| C、T时刻改变的条件是升高温度,PbI2的,Ksp 增大 |
| D、常温下Ksp[PbS]=8×10-28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2-(aq)?PbS(s)+2I-(aq)反应的化学平衡常数为5×1018 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5表面积大能吸附大量的有毒、有害物质 |
| B、PM2.5在空气中形成的分散系为胶体 |
| C、实施绿化工程,可以有效地防治PM2.5污染 |
| D、烟、雾属于胶体,能产生丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com