
| A. | 温度 | B. | 压强 | C. | 浓度 | D. | 催化剂 |
分析 在溶液中进行的反应,溶液浓度、温度、催化剂都可能对反应速率产生影响,只有压强对化学反应速率不产生明显影响,据此分析解答.
解答 解:在溶液中进行的反应,
A.溶液温度改变能改变单位体积内活化分子百分数,所以其对化学反应速率产生明显影响,故A不选;
B.压强大小对溶液体积影响较小,导致溶液浓度影响较小,所以对化学反应速率不产生明显影响,故B选;
C.浓度改变能改变单位体积内活化分子个数,所以其对化学反应速率产生明显影响,故C不选;
D.催化剂能改变单位体积内活化分子百分数,所以其对化学反应速率产生明显影响,故D不选;
故选B.
点评 本题考查外界条件对化学反应速率影响,为高频考点,明确各个条件对化学反应速率影响及其适用范围,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 恒温压缩体积,平衡不移动,颜色加深 | |
| B. | 恒容充入H2,I2的百分比含量降低 | |
| C. | 恒容充入HI,开始时正反应速率减小 | |
| D. | 恒容,降低温度正反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
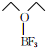 )的熔点为-58℃,沸点为126~129℃,它属于分子晶体.
)的熔点为-58℃,沸点为126~129℃,它属于分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用漏斗过滤,去除盐水中的CaCO3 | B. | 用饱和食盐水洗去Cl2中少量的HCl | ||
| C. | 用CCl4萃取碘水中的碘 | D. | 用升华法除去NaCl中混有的少量碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
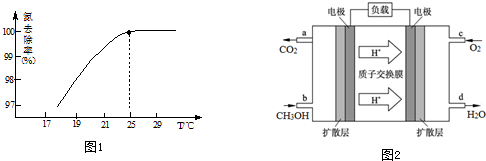
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com