
某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应。已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1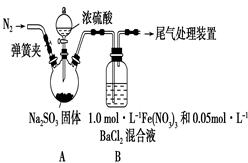
请回答:
(1)装置A中反应的化学方程式是______________________________;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是_______________________________;
(3)装置B中产生了白色沉淀,其成分是________;
(4)分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+、酸性条件下NO3-都反应;
猜想2:SO2与Fe3+反应;
猜想3:在酸性条件下SO2与NO3-反应;
①按猜想2,装置B中反应的离子方程式是_________,证明该猜想正确应进一步确认生成了________;
②按猜想3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是________(填字母)。
a.0.1 mol·L-1稀硝酸
b.1.5 mol·L-1Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol·L-1盐酸等体积混合的溶液
(1)Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O (2)打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹 (3)BaSO4 (4) ①SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+(可分两步写SO2+2Fe3++2H2O=2Fe2++SO42-+4H+、SO42-+Ba2+=BaSO4↓) Fe2+ ②c
解析试题分析::(l)装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O,故答案为:Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O;(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出,操作为打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹,故答案为:打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹;(3)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀,故答案为:BaS04;还原性;(4)假设一 两种离子都氧化二氧化硫,即SO2和Fe3+、酸性条件下NO3-都反应,故答案为:SO2和Fe3+、酸性条件下NO3-都反应;①按观点2,装置B中反应的离子方程式是SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+,可通过检验是否有Fe2+生成的方法判断,具体做法为取少量B中溶液于试管中,加入少量铁氰化钾[K3Fe(CN)6]溶液产生蓝色沉淀,则溶液中有Fe2+,观点2合理,故答案为:SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+;②按观点3,在酸性条件下SO2与NO3-反应,实验中c(NO3-)=3mol/L,则可用6.0mol?L-1NaNO3和0.2mol?L-1盐酸等体积混合的溶液代替,故选c.
考点:本题考查物质的性质实验探究,题目难度中等,注意把握物质的性质,为解答该题的关键,学习中注意相关知识的积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是____________________________________。
(2)将MnO4-氧化Fe2+的离子方程式补充完整: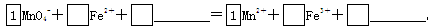
(3)已知:
生成氢氧化物沉淀的pH
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
草酸亚铁(FeC2O4)常用作分析试剂、显影剂以及新型电池材料磷酸亚铁锂的生产。草酸亚铁在隔绝空气时加热能够分解,兴趣小组对草酸亚铁的分解产物进行了实验和探究。(已知:CO能与氯化钯[PdC12]溶液反应生成黑色的钯粉。)
(1)将草酸亚铁分解的气体产物依次通过澄清石灰水和氯化钯溶液,观察到澄清石灰水变浑浊,氯化钯溶液中有黑色物质生成。说明气体产物中有 。(填化学式)
(2)探究草酸亚铁分解得到的黑色固体产物中铁元素的存在形式。
【发现问题】
草酸亚铁分解后得到的黑色物质是什么?
【提出假设】
猜想1: ;猜想2:FeO;猜想3:FeO和Fe的混合物。
【实验方案】
限选试剂:盐酸、氯水、CuSO4溶液、KSCN溶液、蒸馏水。
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 ,充分振荡。 | 若溶液颜色明显改变, 且有红色固体生成。 | 有Fe存在。 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水将固体洗涤至洗涤液呈无色。 | | |
| 步骤3:取步骤2得到的少量固体于试管中,滴加过量盐酸,静置后取上层清液, 。 | 。 | 有FeO存在。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某兴趣小组为测定某工业纯碱(假设仅含NaHCO3杂质)中Na2CO3的质量分数,设计了下列四种实验方案:
方案一:纯碱样品 测定剩余固体质量
测定剩余固体质量
(1)称取mg样品放入坩埚中充分加热。坩埚中发生反应的化学方程式为:
(2)将坩埚置于干燥器中冷却后称量。实验时需要重复“加热、冷却、称量”操作多次,其目的是: 。
方案二:称取mg样品配成250mL溶液,从中取25mL溶液先用酚酞作指示剂用0.1mol/LHCl溶液滴定至终点,消耗0.1mol/LHCl溶液V1mL,继续用甲基橙作指示剂滴定至终点,消耗0.1mol/LHCl溶液V2mL。则该样品中碳酸钠的质量分数为: 。
方案三:纯碱样品溶液 测定沉淀质量
测定沉淀质量
(1)称取m1g样品,置于小烧杯中,加水溶解后滴加足量氯化钙溶液。将反应混和物过滤后的下一步操作是: ,沉淀经干燥后称量为m2g。
(2)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,_______测定样品中的Na2CO3的质量分数。(填“能”或“不能”)
方案四:纯碱样品 测定生成二氧化碳的质量
测定生成二氧化碳的质量
(1)本实验采用如图装置,C中盛放的物质是 。
(2)反应前后都要通入N2,反应后通入N2的目的是: 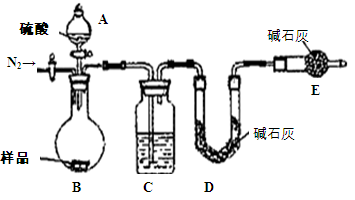
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
I.纯碱、烧碱等是重要的化工原料。
(1)利用上图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是___________________,
若其他操作不变,将A与C连接,可观察到的现象是__________________________。
(2)向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体的组成可能是:
A.NaOH和Na2CO3;B. ;C. ;D. 。
(3)设计实验确定(2)中白色固体中存在A项中的阴离子:
| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | | |
| ② | | |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
【实验设计】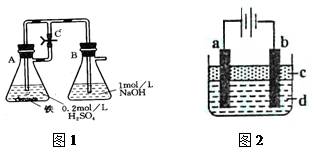
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有: 。
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀。请从所提供的试剂或电极材料中选择正确的序号填在横线上:①纯水 ②NaCl溶液 ③NaOH溶液 ④四氯化碳 ⑤CuCl2溶液 ⑥乙醇 ⑦Fe棒 ⑧植物油 ⑨碳棒
a为___________,b为___________,c为___________,d为___________。(填序号)
【探究思考】
实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到Fe(OH)2如下信息:
| 资料名称 | 物理性质描述 | 化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 | 白色无定形粉末或白色至淡绿色六方晶体 | 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 | 白色沉淀 | 此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 | 白色 | 能强烈吸收O2,迅速变成棕色 Fe(OH)3。这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验。 
(1)能说明有SO2气体产生的实验现象是 。
(2)图2中导气管e的主要作用为 。
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:
。
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是 。
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+; Ⅲ:既有Fe3+又有Fe2+。
为确认溶液的成分,选用如下试剂:
| A.稀HCl溶液 | B.稀硫酸 | C.KSCN溶液 | D.酸性KMnO4溶液 |
| 实验步骤 | 实验现象及结论 |
| 1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 | (1) ,则说明Ⅱ成立。 (2) ,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立。 |
| 2、 | 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
工业生产纯械的工艺流程示意图如下
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(A来源于石灰窑厂),则B的化学式_________。
(2)②过滤后滤液中要通入C和D气体,则先通入的C气体是_________(填化学式),原因是_________。
(3)通入C和D气体后发生反应的化学方程式是_________。
(4)④过滤后,向滤液中通氨气,加入细小食盐颗粒,析出副产品________ (填写化学式),通氨气与加入细小食盐颗粒的作用是_________。
(5)写出⑤锻烧发生反应的化学方程式_________。产品纯碱中含有碳酸氢钠,若用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质童分数ω(NaHCO3)= _________ (注明表达式中所用的有关符号的含义)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
CuSO4是一种重要的化工原料,有关制备途径及性质如下图所示。下列说法错误的是( )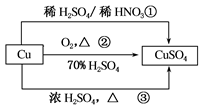
| A.途径①所用混酸中H2SO4与HNO3的最佳物质的量之比为3:2 |
| B.与途径①、③相比,途径②更好地体现了绿色化学思想 |
| C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量①=②<③ |
| D.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com