
【题目】如图为Zn-聚苯胺二次电池的示意图,下列说法正确的是( )
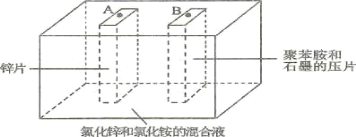
A.放电时,Zn片做负极,发生的电极方程式为Zn + 2e-=Zn2+
B.放电时,混合液中的Cl-向B移动
C.充电时,聚苯胺被氧化
D.充电时,A端接电源的正极
科目:高中化学 来源: 题型:
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3)生产硝酸铜溶液的流程如下:
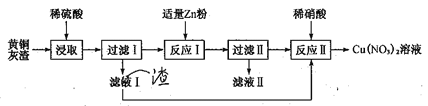
(1)写出酸浸时Fe2O3和稀硫酸反应的离子方程式:_________________。
(2)反应I中所加Zn不能过量的原因是________________。
(3)滤液II中含有的金属阳离子主要有_____________。
(4)写出反应II的离子方程式:______________。反应II应控制温度不能过高也不能过低的原因是___________________。
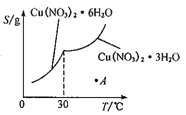
(5)已知Cu(NO3)2·6H2O和Cu(NO3)2·3H2O的溶解度随温度的变化如图所示。则由A点对应的溶液获取Cu(NO3)2·3H2O的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学在网上查询资料时得知,干燥的CO2与Na2O2不能反应,只有在水蒸气存在下二者才能发生反应。他们设计了如图所示实验装置,用于验证上述结论。
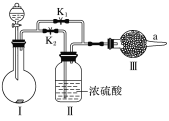
(1)装置Ⅰ中的试剂的最佳组合是________(填字母)。
a.稀盐酸 b.稀硫酸
c.小苏打 d.石灰石
(2)实验时,甲同学认为关闭K1、打开K2,通过观察________判断此时Ⅲ中是否发生了化学反应。
(3)乙同学认为可以分别按“先关闭K1、打开K2,再关闭K2、打开K1”的方式进行操作,并在a处收集所得气体,然后用带火星的木条检验收集到的气体,但他发现两种情况下木条均没有复燃。
①丙同学经过观察分析,建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是________________
②丁同学认为即使采纳丙同学的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是________________________
(4)为进一步达到实验目的,应补充的实验操作是:取最终反应后Ⅲ中所得固体,____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的叙述正确的是( )
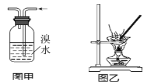
A.将Cl2通入KI淀粉溶液中,溶液先变蓝后褪色,说明Cl2有漂白性
B.图甲用于除去乙烯中的SO2
C.用图乙装置蒸干明矾溶液制KAl(SO4)2·12H2O晶体
D.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如下装置处理含KMnO4的废液,使Mn元素转化为MnO2沉淀,从而消除重金属污染,下列说法错误的是
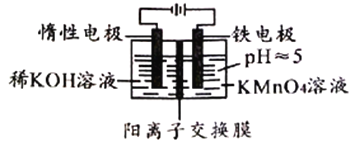
A. MnO4-处理完全后,实验结束时左侧可能会生成沉淀
B. 右侧产生的Fe2+沉淀MnO4-的离子方程式为:7H2O+3Fe2++MnO4-=3Fe(OH)3↓+MnO2↓+5H+
C. 当电路中转移6mole-时,可以产生87gMnO2沉淀
D. 为了增大右侧溶液的导电性可以加稀硫酸造成强酸性环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A、C、E是常见的金属单质,E为紫红色,反应①可用于焊接铁轨,B是赤铁矿的主要成分,F的溶液中加入KSCN溶液变红。(部分反应物和生成物省略)
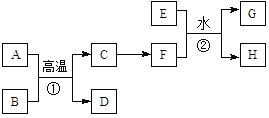
请回答下列问题:
(1)D的化学式是________。
(2)可选用________(填“字母”)实现反应C→F的转化。
a.稀盐酸 b.氯气/点燃 c.CuSO4溶液
(3)反应①的化学方程式为____________。
(4)反应②的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置(固定及夹持装置、加热仪器和橡胶管略)进行有关氨气制取的实验探究。
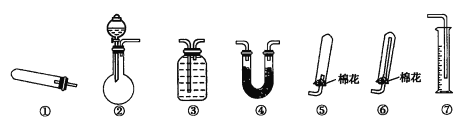
回答下列问题:
(1)若用装置①制取NH3,其反应的化学方程式为__________;若要测定生成的NH3的体积,则必须选择的装置是__________(填装置序号),装置中所盛试剂应具有的性质是__________。
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是__________,分液漏斗中装的试剂是__________,收集装置应选择__________(填装置序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法正确的是
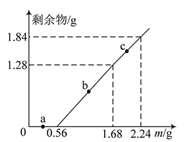
A. a点时溶液中阳离子仅为Cu2+和Fe2+
B. b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C. c点时溶液中溶质的物质的量浓度为0.5 mol·L-1
D. 原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图(I)为全钒电池,电池工作原理为:2H++VO2++V2+![]() VO2++V3++H2O。装置(Ⅱ)中的电解液是硝酸、硫酸的混合水溶液,当闭合开关K时,铂电极上生成NH2OH。则下列说法正确的是( )
VO2++V3++H2O。装置(Ⅱ)中的电解液是硝酸、硫酸的混合水溶液,当闭合开关K时,铂电极上生成NH2OH。则下列说法正确的是( )
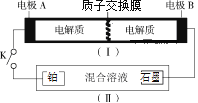
A.闭合K时,全钒电池负极区pH基本不变
B.闭合K时,铂电极的电极反应式为:NO3ˉ+6eˉ+5H2O=NH2OH +7OHˉ
C.全钒电池充电时,电极B上发生还原反应
D.全钒电池放电时,电极B上发生的反应为:VO2++2H++e-=VO2++H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com