
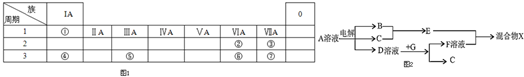
分析 根据元素在周期表中的位置,可知①为H、②为O、③为F、④为Na、⑤为Al、⑥为S、⑦为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)同周期自左而右元素非金属性增强,非金属性越强,最高价含氧酸的酸性越强;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物为H2O2,在酸性溶液中能将Fe2+氧化Fe3+,同时生成水;
(4)由表中元素形成的物质,其中B、C、G是单质,B为黄绿色气体,则B为Cl2,D溶液显碱性,电解A溶液为电解氯化钠溶液生成氢气、氯气与氢氧化钠,故D为NaOH、C为H2,则E为HCl,G能与氢氧化钠溶液反应得到得到氢气与F,故G为Al,F为NaAlO2,据此解答即可;
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),则W为Na2S2O3,在酸性溶液中Na2S2O3发生自身氧化还原有硫生成,溶液发黄,在溶液中易被氯气氧化,生成硫酸根和氯离子.
解答 解:根据元素在周期表中的位置,可知①为H、②为O、③为F、④为Na、⑤为Al、⑥为S、⑦为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Cl>F,故答案为:Na>Cl>F;
(2)非金属性Cl>S,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4,故答案为:HClO4>H2SO4;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物为H2O2,在酸性溶液中能将Fe2+氧化Fe3+,同时生成水,反应离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)由表中元素形成的物质,其中B、C、G是单质,B为黄绿色气体,则B为Cl2,D溶液显碱性,电解A溶液为电解氯化钠溶液生成氢气、氯气与氢氧化钠,故D为NaOH、C为H2,则E为HCl,G能与氢氧化钠溶液反应得到得到氢气与F,故G为Al,F为NaAlO2,则:
①D溶液与G反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②检验NaCl溶液中溶质的阴离子的方法:取少量A溶液滴加几滴(稀硝酸酸化)硝酸银溶液有白色沉淀生成,故答案为:取少量A溶液滴加几滴稀硝酸酸化的硝酸银溶液有白色沉淀生成;
③常温下,若电解1L 0.1mol/L的NaCl溶液,一段时间后测得溶液中的c(OH -)=10-2mol/L,则n(NaOH)=0.01mol/L×1L=0.01mol,由2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,可知成氯气为0.01mol×$\frac{1}{2}$=0.005mol,故转移电子物质的量=0.005mol×2=0.01mol,故答案为:0.01mol;
④过量的盐酸与偏铝酸钠反应生成铝离子和水,离子反应方程式为:AlO2-+4H+=Al3++2H2O,故答案为:AlO2-+4H+=Al3++2H2O;
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),则W为Na2S2O3,在酸性溶液中Na2S2O3发生自身氧化还原有硫生成,溶液发黄,在溶液中易被氯气氧化,生成硫酸根和氯离子,在溶液中与氯气反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+,故答案为:S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
点评 本题考查元素周期表与元素周期律、无机物的推断,难度中等,注意题中与量有关的离子方程式的书写和氧化还原反应的方程式的书写,需要学生具备扎实的基础.


科目:高中化学 来源: 题型:解答题
 原子序数小于36的X、Y、Z、W四种元素,X基态原子的最外层电子数是其内层电子数的2倍,Y基态原子的2p原子轨道上有3个未成对电子,Z是地壳中含量最多的元素,W的原子序数为22.
原子序数小于36的X、Y、Z、W四种元素,X基态原子的最外层电子数是其内层电子数的2倍,Y基态原子的2p原子轨道上有3个未成对电子,Z是地壳中含量最多的元素,W的原子序数为22.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属加成反应 | B. | 乙烯可以通过石油裂解获得 | ||
| C. | 乙醇官能团为羟基 | D. | 乙醇、乙醛和乙酸互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
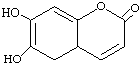
| A. | M的相对分子质量是178 | |
| B. | M有机物中含有2种官能团 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H9O5Na | |
| D. | 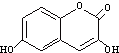 与M互为同分异构体 与M互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成; 乙烯与水生成乙醇的反应 | |
| D. | 在苯中滴入溴水,溴水褪色;乙烯自身生成聚乙烯的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n( N2) | 0 | 0.20 | 0.35 | 0.40 | 0.40 |
| T2 | n( N2) | 0 | 0.25 | … | 0.30 | 0.30 |
| A. | 10min内,T1时的v(N2)比T2时的小 | |
| B. | T1<T2 | |
| C. | a<0 | |
| D. | T2时,若向平衡后的容器中再充入1.2molCH4,重新达到平衡时n(N2)=0.40mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| X | Y | ||
| Z | W |
| A. | W的原子半径最大 | |
| B. | Z与X形成的化合物难溶于水 | |
| C. | Y的单质不能与水反应 | |
| D. | Z元素的氧化物对应水化物的酸性一定弱于W的氧化物对应水化物的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | c(OH-)•c(H+) | ||
| C. | c (OH-) | D. | H+的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com