
 5H3AsO4+4Br2+4K2SO4+4H2O.
5H3AsO4+4Br2+4K2SO4+4H2O.分析 由信息可知,该反应中氧化剂是KBrO3,还原剂是AsH3,溴元素化合价变化为由+5价降低,As元素化合价变化为-3→+5价,
(1)化合价升高元素所在的反应物是还原剂;
(2)根据溴元素化合价的降低情况来计算;
(3)化合价升高的元素是砷元素,化合价从-3价升到+5价,化合价降低的元素是溴元素,化合价从+5价降到0价,方程式为:4H2SO4+5AsH3+8KBrO3═5H3AsO4+4Br2+4K2SO4+4H2O,化合价升高和降低数目得相等,所以转移40e-;
(4)根据氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,据此判断;
解答 解:(1)KBrO3在反应中得到电子,所以KBrO3化合价降低是氧化剂,AsH3变成了H3AsO4,所以AsH3是还原剂;
故答案为:AsH3;
(2)设X中溴元素的化合价为x,则0.2mol(5-x)=1mol,所以x=0,故X为Br2,
故答案为:Br2;
(3)化合价升高的元素是砷元素,化合价从-3价升到+5价,化合价降低的元素是溴元素,化合价从+5价降到0价,方程式为:4H2SO4+5AsH3+8KBrO3═5H3AsO4+4Br2+4K2SO4+4H2O,化合价升高和降低数目得相等,所以转移40e-,则电子转移的方向和数目为 5H3AsO4+4Br2+4K2SO4+4H2O,
5H3AsO4+4Br2+4K2SO4+4H2O,
故答案为: 5H3AsO4+4Br2+4K2SO4+4H2O;
5H3AsO4+4Br2+4K2SO4+4H2O;
(4)a、反应中KBrO3是氧化剂,H3AsO4是氧化产物,氧化性为KBrO3>H3AsO4,故a正确,b错误;
c、AsH3是还原剂,X是还原产物,所以还原性AsH3>X,故c正确,故d错误.
故答案为:ac.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
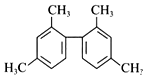
| A. | 分子中至少有11个碳原子处于同一平面上 | |
| B. | 分子中至少有10碳原子处于同一平面上 | |
| C. | 该烃核磁共振氢谱图中有4个吸收峰 | |
| D. | 该烃属于苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
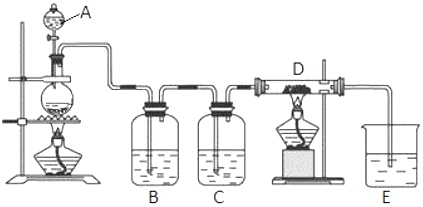
 混有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作,回答下列问题:
混有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
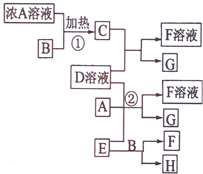 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质,且受热易升华.实验室中,常用固体E在B的催化下加热制取气体单质H,H能使带火星的木条复燃.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质,且受热易升华.实验室中,常用固体E在B的催化下加热制取气体单质H,H能使带火星的木条复燃.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单氢化物的沸点:Z>W | |
| B. | 由W、Y两种元素形成的化合物一定不含共价键 | |
| C. | 简单气态氢化物的热稳定性:X>W | |
| D. | 元素Y和Z的简单离子具有相同的电子层结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com