
分析 (1)镁能在二氧化碳中燃烧;
(2)酸性环境下过氧化氢氧化铜生成铜离子;
(3)NaAlO2溶液中通入过量的CO2反应生成氢氧化铝和碳酸氢钠,以此来解答;
(4)铁离子水解生成胶体,可净化水;酸性溶液中抑制铁离子的水解,酸性条件下亚铁离子与重铬酸根离子发生氧化还原反应,以此来解答;
(5)与量有关的反应,现象不同,可利用相互滴加的实验方法鉴别,以此来解答.
解答 解:(1)镁能在二氧化碳中燃烧,化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(2)用H2O2和稀H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,反应生成硫酸铜和水,化学方程式:Cu+H2SO4+H2O2═CuSO4+2H2O;
故答案为:Cu+H2SO4+H2O2═CuSO4+2H2O;
(3)NaAlO2溶液中通入过量的CO2反应生成氢氧化铝和碳酸氢钠,离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(4)Fe2(SO4)3 净水的原理是Fe3++3H2O?Fe(OH)3(胶体)+3H+,生成的少量Fe(OH)3胶体可以吸附水中的悬浮杂质,达到净水的目的;
使用时发现Fe2(SO4)3 并不能使酸性废水中的悬浮物沉降除去,其原因是因为在酸性废液中,H+会抑制Fe3+的水解,无法得到Fe(OH)3胶体,所以不能够吸附悬浮物;
在酸性环境下,向含重铬酸根的废水中加入FeSO4溶液,然后调节pH,使生成的Cr3+转化为Cr(OH)3,第一步反应的离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,
故答案为:Fe3++3H2O?Fe(OH)3(胶体)+3H+,生成的少量Fe(OH)3胶体可以吸附水中的悬浮杂质,达到净水的目的;因为在酸性废液中,H+会抑制Fe3+的水解,无法得到Fe(OH)3胶体,所以不能够吸附悬浮物;Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O;
(5)①硫酸铝和氨水的反应与量无关,改变滴加顺序均生成白色沉淀,不能鉴别,故不选;
②偏铝酸钠和稀盐酸反应与量有关,盐酸足量不生成沉淀,盐酸少量生成白色沉淀,改变滴加顺序现象不同,能鉴别,故选;
③硫酸锌和氢氧化钠的反应与量有关,NaOH不足生成白色沉淀,NaOH过量沉淀溶解,改变滴加顺序现象不同,能鉴别,故选;
④硫酸锌和氨水的反应与量有关,氨水不足生成白色沉淀,氨水过量沉淀溶解,改变滴加顺序现象不同,能鉴别,故选;
故答案为:②③④.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与实验能力的考查,注意习题信息及元素化合物知识的应用,题目难度不大.


科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:选择题
如图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法错误的是
A.铜片表面有气泡生成
B.装置中存在“化学能→ 电能→ 光能”的转换
C.如果将硫酸换成柠檬汁,导线中不会有电子流动
D.如果将锌片换成铁片,电路中的电流方向不变
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
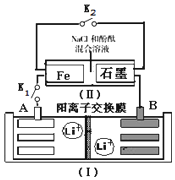 如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )
如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )| A. | 闭合K1,断开K2时,若将Fe电极和石墨电极互换,装置(Ⅱ)中发生的总反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ | |
| B. | 闭合K1,断开K2时,当0.1 mol Li+从A极区迁移到B极区,理论上Fe电极上产生的气体体积为1.12 L(标准状况下) | |
| C. | 取下锂离子电池充电,电极A为阳极,发生还氧化反应,电极上发生的电极反应式为:Li7Ti5O12-3e-═Li4Ti5O12+3 Li+ | |
| D. | 若开始时,断开K1,闭合K2,一段时间后,石墨电极附近显红色,则该电极反应为:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量为0.5 mol的MgCl2中,含有Mg2+个数为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气、硫酸铜、H2SO4 | B. | HCl、Fe(OH)3胶体、纯碱 | ||
| C. | 二氧化碳、胆矾、氢氧化钾 | D. | HNO3、食盐水、烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | 中性溶液:Fe3+、K+、Cl-、SO42- | |
| C. | c(H+)/c(OH-)=10-10的溶液:Ba2+、NO3-、Cl- | |
| D. | c(ClO-)=1.0mol•L-1的溶液:Na+、SO32-、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com