
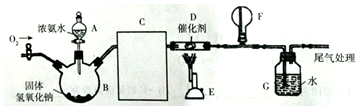
分析 装置B是制取氨气装置,装置C是干燥碱性气体装置,装置D是氨气和氧气的发生装置,装置F气体收集装置,装置G尾气处理装置,据此进行分析.
(1)据氢氧化钠固体溶于水放热,并且电离产生的OH-,使NH4++OH-?NH3•H2O?NH3↑+H2O向正向移动,使氨气逸出,据此进行分析;
(2)装置B是制取氨气装置,故装置C是干燥碱性气体氨气装置;
(3)①装置D是氨气和氧气的发生装置;据此反应为放热反应来分析;
②P2O5用于干燥酸性气体氯气、CO2、SO2、NO2等和中性气体CO、NO、N2、O2等的干燥;一氧化氮和氧气反应生成二氧化氮;
(4)pH=-lgc(H+)进行计算.
解答 解:装置B是制取氨气装置,装置C是干燥碱性气体装置,装置E是氨气和氧气的发生装置,装置F气体收集装置,装置G尾气处理装置,
(1)装置B中固体氢氧化钠的作用是:氢氧化钠固体溶于水放热,使氨气溶解度减小,且电离出OH-,使NH4++OH-?NH3•H2O?NH3↑+H2O向正向移动,
故答案为:氢氧化钠固体溶于水放热,使氨气溶解度减小,且电离出OH-,使NH4++OH-?NH3•H2O?NH3↑+H2O向正向移动;
(2)装置B是制取氨气装置,故装置C是干燥碱性气体氨气装置,故装置为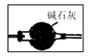 ,
,
故答案为: ;
;
(3)①装置D是氨气和氧气的发生装置,故化学方程式为4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O;开始反应一段时间后,撤离热源反应也可以持续进行,原因为此反应为放热反应,反应放出的热量可维持反应继续进行,
故答案为:4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O;此反应为放热反应,反应放出的热量可维持反应继续进行;
②F中可能出现白烟,也就是形成了铵盐,故在制硝酸之前需把氨气除去,故用P2O5作用是干燥酸性气体和中性气体,可间接的把氨气除去;一氧化氮和氧气反应生成二氧化氮,故反应方程式为2NO+O2=2NO2,
故答案为:a;2NO+O2=2NO2;
(4)n(NaOH)=0.002mol/L×0.01L=2×10-5mol,
NaOH+HNO3=NaNO3+H2O,
1 1
2×10-5 2×10-5,则n(HNO3)=2×10-5mol,则c(HNO3)=$\frac{2×1{0}^{-5}mol/L}{0.02L}$=1×10-3mol/L,故pH=-lgc(H+)=-lg1×10-3=3,
故答案为:3.
点评 本题考查硝酸的制备装置、实验装置评价与理解、氨气的性质、关键是清楚实验的目的与原理,注意固体P2O5作用是干燥酸性气体和中性气体,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1.25g | B. | 1.32g | C. | 1.97g | D. | 2.44g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NH•H2O=1.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NH•H2O=1.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定二甲胺溶液的曲线 | |
| B. | a点溶液与d点的溶液混合后的溶液中:c[(CH3)2NH2+)]<c[(CH3)2NH•H2O] | |
| C. | d点溶液中:c(H+)=c(OH-)+c[(CH3)2NH•H2O] | |
| D. | b、c、e三点的溶液中,水的电离程度最大的是b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m、n、q一定是非金属元素 | |
| B. | 氢化物的沸点:q>n>m | |
| C. | 离子半径的大小:q>n>p | |
| D. | m与q形成的二元化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

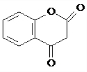 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应必然伴随发生能量变化 | |
| B. | 化学反应中的能量变化主要是由化学键变化引起的 | |
| C. | 反应物的总能量与生成物的总能量一定相等 | |
| D. | 化学反应中既有物质变化又有能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 结论 | |
| A | 向浓度均为0.1mol/L的NaHCO3溶液和NaHSO3溶液中滴加几滴酚酞试剂 | 前者溶液变红,后者不变色 | NaHCO3水解,而NaHSO3不水解 |
| B | 向NaAlO2溶液中通入NH3 | 白色沉淀 | Al(OH)3不能溶解在弱碱中 |
| C | 向滴有品红的水中通入SO2 | 溶液红色褪去 | SO2具有氧化性 |
| D | 将充有NO2的密闭烧瓶放入热水中 | 烧瓶内气体颜色变深 | NO2生成N2O4的反应中,△H<0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com