
| A、0.2mol?L-1HF溶液与0.1mol?L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(F-)-c(HF) |
| B、0.1mol?L-1KHCO3溶液中:c(CO32-)+c(OH-)=c(H+)+2c(H2CO3) |
| C、pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH+)>c(OH-)=c(H+) |
| D、新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
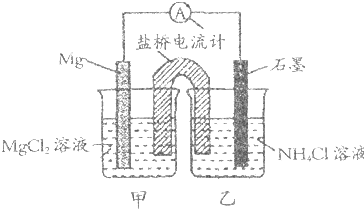
| A、石墨电极反应式为2NH4++2e-=2NH3↑+H2↑ |
| B、乙烧杯中一直存在:c(Cl-)<c(NH4+) |
| C、电子流向是由石墨→导线→Mg |
| D、盐桥中的Cl-移向乙烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图在下衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴KBr溶液,品红溶液,含有酚酞的澄清石灰水,FeC12溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿.提示:实验室中所用的少量氯气可以用下述原理制取:
如图在下衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴KBr溶液,品红溶液,含有酚酞的澄清石灰水,FeC12溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿.提示:实验室中所用的少量氯气可以用下述原理制取:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水和氯化铵的混合液,当pH=7时,c(Cl-)>c(NH4+) |
| B、pH=2的一元酸和pH=12的NaOH溶液等体积混合,混合液中c(H+)不一定等于c(OH-) |
| C、0.1mol/L的Na2CO3溶液中:c(Na+)=c(H2CO3)+c(HCO3-)+2c(CO32-) |
| D、PH=3的H2SO4和NaCl溶液中,一定存在c(Na+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度相等的溶液pH关系:pH(NaClO)>pH(Na2CO3)>pH(CH3COONa) |
| B、向NaClO溶液中通少量CO2:CO2+NaClO+H2O→NaHCO3+HClO |
| C、a mol/L HClO与b mol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(ClO-),则a一定小于b |
| D、向氯水中加入NaHCO3固体,可以增大氯水中次氯酸的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压下,相同体积的物质,其物质的量一定相等 |
| B、不同的外界条件下,等物质的量的甲烷和一氧化碳所含的分子数不一定相等 |
| C、14g一氧化碳气体一定比20 g氧气的体积小 |
| D、相同条件下的一氧化碳气体和氮气,若体积相等,则分子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com