
【题目】某研究性学习小组设计了如下装置制取和验证SO2的性质。

请回答:
(1)写出图中仪器的名称:a___________,b___________。
(2)棉球中NaOH溶液的作用是______________________。
(3)为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是_____________________。
A.紫色石蕊试液 B.无色酚酞试液 C.澄清石灰水 D.碘水
(4)下列说法正确的是____________。
A.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
B.先向装置中加入试剂(药品),再进行气密性检查
C.实验开始后,洗气瓶①和③只溶液均褪色,两者均可证明SO2具有漂白性
D.实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性
(5)洗气瓶④中发生反应的离子方程式为________________________。
【答案】 分液漏斗 干燥管 吸收尾气,防止SO2污染大气 AC D SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+或写出SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;Ba2++SO42-=BaSO4↓
【解析】(1)由装置图可知仪器a的名称为分液漏斗,仪器b的名称为干燥管;
(2)干燥管在装置最后,其中棉球上蘸有NaOH溶液,其作用是吸收有害尾气SO2,防止污染空气;
(3)A、酸性氧化物可与水反应生成相应的酸,所以要验证SO2是酸性氧化物,可验证其水溶液是否显酸性,因此可在洗气瓶②中盛放紫色石蕊试液,则A正确;B、酸与酚酞不变色,所以B错误;C、酸性氧化物能与碱反应生成盐和水,故要验证SO2是酸性氧化物,也可在洗气瓶②中盛放澄清石灰水,所以C正确;D、碘水与SO2反应而褪色,但表现的是SO2的还原性,故D错误。因此正确答案为AC;
(3)A、实验开始时,要先打开分液漏斗上口的塞子,再打开分液漏斗的旋塞,液体才能顺利滴下,故错误;B、装置的气密性检查是在装药品之前进行的,故B 错误;C、实验开始后,洗气瓶①中的品红溶液褪色,证明SO2具有漂白性,而洗气瓶③中的溴水褪色,能证明SO2具有还原性,所以C错误;D、洗气瓶④中的FeCl3具有较强的氧化性,可将SO2氧化为SO42—,再与Ba2+反应生成白色沉淀,所以该现象说明SO2具有还原性,故D正确。因此正确答案为D;
(4)洗气瓶④中发生反应的离子方程式为SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+(或写出SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;Ba2++SO42-=BaSO4↓)。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为( )
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
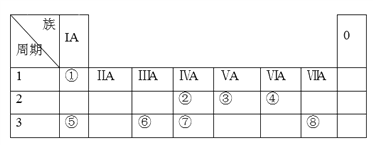
(1)①的元素符号为______;②的元素符号为______;③的元素符号为______;④的元素符号为______;⑤的元素符号为______;⑥的元素符号为______;⑦的元素符号为______;⑧的元素符号为_______。
(2)⑧的气态氢化物为_____________(填化学式)。
(3)⑤对应的碱的化学式为__________;③的最高价含氧酸为___________(填化学式)。
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)CH3﹣CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
化学键 | C﹣H | C=C | C﹣C | H﹣H |
键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
试计算该反应的反应热△H= .
(2)白磷与氧可发生如下反应:P4(S)+5O2(g)=P4O10(S) . 已知断裂下列化学键需要吸收的能量分别为如下
化学键 | P﹣P | P﹣O | P=O | O﹣O | O=O |
键能(kJ/mol) | a | b | c | d | e |
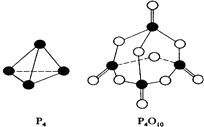
根据图示的分子结构和有关数据估算该反应的△H=;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气. 已知:①N2(g)+2O2(g)=N2O4(1)△H1=﹣195.0kJmol﹣1
②N2H4(1)+O2(g)=N2(g)+2H2O(g)△H2=﹣534.2kJmol﹣1
写出肼和N2O4反应的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示(b处NaOH的体积为1L),则下列判断错误的是 ( )

A. NaOH的浓度为0.6 mol·L-1 B. 在a点处溶液中的溶质为NaCl
C. 混合溶液中n(Al3+)﹕n(Mg2+)=1﹕1 D. 图中线段oa : ab=4﹕1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在科研与生活中有重要应用.某兴趣小组用0.50molL﹣1KI、0.2%淀粉溶液、0.20molL﹣1K2S2O8、0.10molL﹣1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知: S2O82﹣+2I﹣═2SO42﹣+I2(慢) I2+2S2O32﹣═2I﹣+S4O62﹣(快)
(1)向KI,Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的耗尽后,溶液颜色将由无色变成为蓝色.其中该反应速率快慢的是由(填“第一个”或“第二个”)反应决定的.为确保能观察到蓝色,S2O32﹣与S2O82﹣初始的物质的量需满足的关系为:n(S2O32﹣):n(S2O82﹣) .
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 | 体积/mL溶液 | ||||
K2S2O8溶液 | H2O | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | V1 | V3 | 4.0 | 2.0 |
③ | 8.0 | V2 | V4 | V5 | 2.0 |
表中V3、V4和V5取实验设计的体积数值,目的是 , 表中的V2= , 理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应 :2NaClO2 + Cl2 ===2ClO2 + 2NaCl。
下图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。
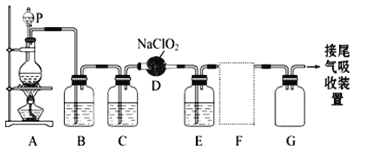
(1)仪器P的名称是_________________。
(2)写出装置A中烧瓶内发生反应的离子方程式:______________________________。
(3)B装置中所盛试剂是____________________。
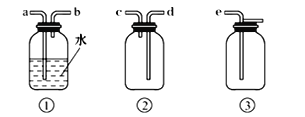
(4)F为ClO2收集装置,应选用的装置是___________(填序号),其中与E装置导管相连的导管口是__________(填接口字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法不正确的是( )
A. 同温同压时,决定气体体积大小的是气体的物质的量
B. 同温同压时,同质量的三种气体,气体密度最小的是X
C. 同温同压时,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1mol
D. 同温下,体积相同的两容器分别充2gY气体和lgZ气体,则其压强比为4:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com