
【题目】Fe及其化合物在日常生活中有很多应用,请按要求填空:
(1)人体内的铁元素以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。这句话说明维生素C在这一反应中起的作用是_______。(填“还原性”或“氧化性”)
(2)Fe2+是一种非常好的还原剂,能够与很多氧化剂发生反应。在加热条件下,FeSO4可与硫酸酸化的KNO3反应,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NO气体。
①请写出该化学反应方程式,并用单线桥表示出电子转移的方向和数目______。
②上述反应发生还原反应的物质是___。
③若11.4gFeSO4参与反应,则产生NO气体的体积(标况下) ______L。
(3)难溶物FeS能够与硫酸酸化的KMnO4溶液反应,反应方程式如下:10FeS+6KMnO4+24H2SO4=3K2SO4+6MnSO4+5Fe2(SO4)3+l0_____+24H2O
①横线上的物质的化学式是。
②该反应的氧化产物是___。
③若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生转移的电子数为___。
【答案】还原性 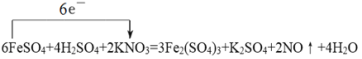 KNO3 0.56L S S、Fe2(SO4)3 0.1NA
KNO3 0.56L S S、Fe2(SO4)3 0.1NA
【解析】
(1)维生素C可使食物中的Fe3+还原成Fe2+,维生素C为还原剂,体现还原性,故答案为:还原性;
(2)①反应中铁元素化合价从+2价升高到+3价,失去1个电子。氮元素化合价从+5价降低到+2价,得到3个电子,根据电子得失守恒可知该反应的化学方程式为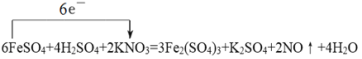 。
。
②根据以上分析可知上述反应发生还原反应的物质是KNO3,故答案为:KNO3;
③11.4gFeSO4的物质的量是11.4g÷152g/mol=0.075mol,所以根据方程式可知产生NO是0.075mol÷3=0.025mol,在标准状况下的体积为0.025mol×22.4L/mol=0.56L。故答案为:0.56L;
(3)①根据原子守恒可知横线上物质的化学式是S;
②反应中Fe和S元素的化合价升高,Mn元素的化合价降低,则该反应的氧化产物是S、Fe2(SO4)3,故答案为:S、Fe2(SO4)3;
③若上述反应前后固体的质量减少了2.8g,根据方程式可知减少的质量是Fe,物质的量是2.8g÷56g/mol=0.05mol,因此参加反应的FeS的物质的量是0.05mol,S元素化合价从-2价升高到0价,所以硫元素与KMnO4之间发生转移的电子的物质的量是0.05mol×2=0.1mol,电子数为0.1NA,故答案为:0.1NA。


科目:高中化学 来源: 题型:
【题目】一定温度下在容积为5L的密闭容器中,通入5 molN2和8 molH2,在一定条件下反应生成NH3,当反应进行到2 min时,测得容器内有4 molNH3。则:
(1)求2 min内,H2的平均反应速率。_____
(2)求2min时N2的转化率。______
(3)2 min时,求容器内气体的压强与反应前气体压强的比值。(不用写计算过程)___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L
B.物质的量浓度为0.5 mol/L的MgCl2溶液中含有NA个Cl-
C.标准状况下,11.2 L H2O含有的分子数为0.5 NA
D.在常温常压下,1.06 g Na2CO3含有的Na+数为0.02 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )

A.放电时,甲电极为正极,OH-移向乙电极
B.放电时,乙电极反应为:Ni(OH)2+OH-—e-=NiO(OH)+H2O
C.充电时,电池的碳电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水中氨氮(NH3、NH4+)采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:①微生物脱氮法:NH4+ ![]() NO3-
NO3- ![]() N2;②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成MgNH4PO4·6H2O沉淀从而去除氨氮,下列有关说法正确的是
N2;②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成MgNH4PO4·6H2O沉淀从而去除氨氮,下列有关说法正确的是
A. 该废水大量直接排放,对水体的影响不大
B. 微生物脱氮时可在高温下进行,以加快脱氮的速率
C. 步骤a发生反应:NH4++2O2=NO3-+H2O+2H+
D. 化学沉淀法脱氮时,溶液的碱性越强,氨氮的去除率将升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) =CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) =2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) =2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
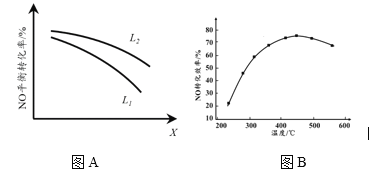
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系______,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<”或“=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
A.催化剂活性降低 B.平衡常数变小 C. 反应活化能增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 molA气体和2mol B气体在2L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g),若经2s后测得C的浓度为0.6mol·L-1,则
2C(g),若经2s后测得C的浓度为0.6mol·L-1,则
(1)用物质A表示的反应速率为____。
(2)用物质B表示的反应速率为____。
(3)2s时物质B的转化率为_____。
(4)2s时物质A的浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题.

(1)该浓盐酸中HCl的物质的量浓度为 ______ molL-1.
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______ .
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次并在操作步骤空白处填上适当仪器名称) ______ .
A.用30mL水洗涤 ______ 2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用 ______ 加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(4)在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括 号内填“偏大”,“偏小”,或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面 ______
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com