


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
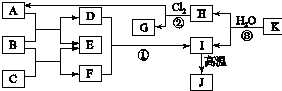 如图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源、燃料,J是一种耐高温材料且是两性氧化物,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).
如图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源、燃料,J是一种耐高温材料且是两性氧化物,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).查看答案和解析>>
科目:高中化学 来源: 题型:
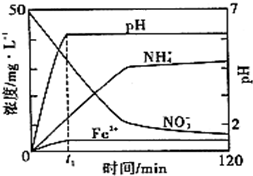 I.铁盐、亚铁盐是实验室常用的药品.
I.铁盐、亚铁盐是实验室常用的药品.| SO | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
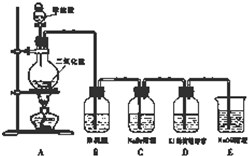 某校研究性学习小组设计实验,制取氯气以探究Cl2、Br2、I2的氧化性强弱(制取氯气的化学方程式为:MnO2+4HCl(浓)
某校研究性学习小组设计实验,制取氯气以探究Cl2、Br2、I2的氧化性强弱(制取氯气的化学方程式为:MnO2+4HCl(浓) | △ |
. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液 |
| B、NaHCO3溶液 |
| C、Na2SO3溶液 |
| D、CH3COONa溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Fe2+、Cl-、NO3- |
| B、Na+、NH4+、HCO3-、SO42- |
| C、NH4+、Ca2+、NO3-、Cl- |
| D、Na+、K+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠溶液跟过量的饱和石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| B、向Ba(OH)2溶液中滴加NaHSO4溶液至溶液显中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| C、氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- |
| D、澄清石灰水中通入少量CO2:Ca(OH)2+CO2═CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com