
有机物A分子的结构简式为: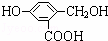
(1)A跟NaOH溶液反应的化学方程式是: ;
(2)A跟NaHCO3溶液反应的化学方程式是: ;
(3)A在一定条件下跟Na反应的化学方程式是 .
考点:
有机物的结构和性质;化学方程式的书写;有机物分子中的官能团及其结构.
专题:
有机物的化学性质及推断.
分析:
该有机物含酚﹣OH、醇﹣OH、﹣COOH,酚﹣OH与﹣COOH能与NaOH溶液反应,只有﹣COOH与NaHCO3溶液反应,但三种官能团均能与Na反应生成氢气,以此来解答.
解答:
解:(1)酚﹣OH与﹣COOH能与NaOH溶液反应,A跟NaOH溶液反应的化学方程式为 ,
,
故答案为: ;
;
(2)只有﹣COOH与NaHCO3溶液反应,A跟NaHCO3溶液反应的化学方程式为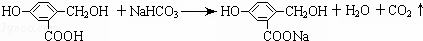 ,
,
故答案为: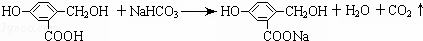 ;
;
(3)三种官能团均能与Na反应生成氢气,A在一定条件下跟Na反应的化学方程式为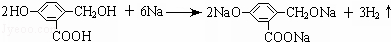 ,
,
故答案为: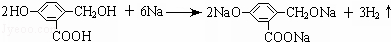 .
.
点评:
本题考查有机物的结构与性质,注意把握有机物的官能团与性质的关系,熟悉酚、醇、羧酸的性质即可解答,题目难度不大.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
铁的锈蚀是工业上研究的重点内容.为研究铁锈蚀的影响因素,某同学用相同的铁丝在不同的气流中做了如下探究实验,记录如下:
| 序号 | 铁丝状态 | 温度℃ | 气流湿度 | 气流成分 | 时间 | 现象 |
| ① | 洁净光亮 | 25 | 干燥 | 空气 | 一个月 | 铁丝表面光亮 |
| ② | 洁净光亮 | 25 | 潮湿 | 空气 | 一天 | 铁丝表面光亮 |
| ③ | 洁净光亮 | 25 | 潮湿 | 空气 | 一个月 | 铁丝表面已经变暗 |
| ④ | 洁净光亮 | 25 | 潮湿 | 氧气 | 一天 | 铁丝表面略微变暗 |
| ⑤ | 洁净光亮 | 40 | 潮湿 | 氧气 | 一天 | A |
| ⑥ | 光亮铁丝表面有氯化钠溶液 | 25 | 潮湿 | 氧气 | 一天 | 铁丝表面变暗程度比④严重 |
回答以下问题:
(1)上述实验中发生了吸氧腐蚀的是 (填实验序号),正极反应式是 ﹣
(2)实验④⑥说明 是影响铁锈蚀的主要因素.如果实验④⑤是为说明温度对铁锈蚀速率的影响,则A处观察到的现象可能是 .
(3)为防止铁的锈蚀,地下埋的水管采用外接电源阴极保护法,则水管接电源的 极(填“正”或“负”)
查看答案和解析>>
科目:高中化学 来源: 题型:
以下物质间的转化通过一步反应不能实现的是()
①HCl→Cl2→HClO→NaClO
②Na→Na2O2→Na2CO3→NaHCO3
③Al→NaAlO2→Al(OH)3→Al2O3
④Si→SiO2→H2SiO3→Na2SiO3
⑤S→SO3→H2SO4→Na2SO4
⑥Cu→CuCl2→Cu(OH)2.
A. ②③ B. ④⑤ C. ③④⑤⑥ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A的结构简式为: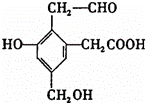 ,取Na、NaOH、新制Cu(OH)2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、新制Cu(OH)2三种物质的物质的量之比为( )
,取Na、NaOH、新制Cu(OH)2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、新制Cu(OH)2三种物质的物质的量之比为( )
|
| A. | 6:4:5 | B. | 1:1:1 | C. | 3:2:3 | D. | 3:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列说法正确的是( )
|
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA |
|
| B. | 28g乙烯所含共用电子对数目为4NA |
|
| C. | 1 mol甲基的电子数目为9NA |
|
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O  4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH= 的溶液。
(2)高铁酸钾有以下几种常见制备方法:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式: 。
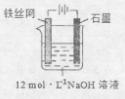
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为 ,正极反应为: 。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L,含有2.0×l0-4 mol·L-l K2FeO4的废水中有CaFeO4沉淀产生,理论上至少加入Ca(OH)2的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
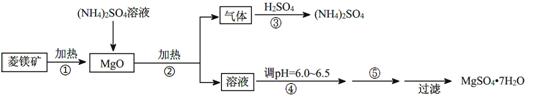 (1)步骤②中发生反应的离子方程式为 。
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为
[25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
查看答案和解析>>
科目:高中化学 来源: 题型:
在某温度时将2 mol A和1 mol B两种气体通入容积为2 L的密闭容器中,发生如下反应:2A(g)+B(g)x C(g),2 min时反应达到平衡状态,经测定B的物质的量为0.4 mol,C的反应速率为0.45 mol·L-1·min-1。下列各项能表明该反应达到平衡的是( )
A.vA(正):vB(逆)=2:1
B.C的物质的量为1.2 mol
C.混合气体的压强不再变化
D.混合气体的总质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
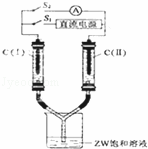
2X、Y、Z、W为按原子序数由小到大排列的四种短周期元素.已知:①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物.请回答:
(1)Z2Y的化学式是 .
(2)Z2Y2与X2Y反应的化学方程式是 .
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极.接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成,则电解的总反应式为 .一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.此时:C(Ⅰ)的电极名称是 (填写正极或负极);C(Ⅱ)的电极反应式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com