
【题目】为了防止番茄在长途运输中发生腐烂,常常运输尚未完全成熟的果实,运到目的地后再用一种植物生长调节剂将其催熟。这种植物生长调节剂是下列物质中的
A. 乙烷 B. 乙烯 C. 乙炔 D. 乙醇
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】已知H2(g)+Br2(g)===2HBr(g) ΔH=-72 kJ/mol,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol 分子中的化学键断 裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为( )
A.404B.260C.230D.200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、Q、W、R的原子序数与其常见化合价关系如下图所示。下列说法正确的是
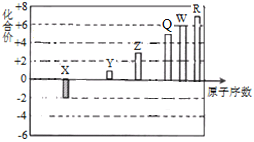
A. X、Y、R形成的某种化合物可以用于漂白、消毒
B. Q、W的最高价氧化物对应的水化物酸性前者大于后者
C. X、Y、Z、W、R的简单离子半径大小顺序为R>W>Z>Y>X
D. Y、Z和W三者最高价氧化物对应的水化物间不能两两相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某有机物分子的简易球棍模型,该有机物中含C、H、O、N四种元素。下列关于该有机物的说法中错误的是( )
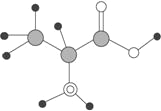
A. 分子式为C3 H7O2N B. 能发生取代反应
C. 能通过聚合反应生成高分子化合物 D. 不能跟NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种碳架如图的烃(小黑球表示碳原子,黑球之间的连线表示共价键),下列说法正确的是( )
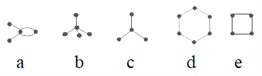
①a和e互为同分异构体 ②b是天然气的主要成分 ③d为平面型分子,属于芳香烃 ④b和c互为同系物 ⑤a、d、e的最简式相同
A. ①③⑤ B. ①②③ C. ②③④ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,一定量的Na2C03与盐酸混合所得溶液中,部分含碳微粒的物质的量分数(![]() )与pH的关系如图所示。下列说法正确的是
)与pH的关系如图所示。下列说法正确的是

A. 曲线X表示的微粒为CO32-
B. pH=6.3时,![]() (CO32-)+
(CO32-)+![]() (HCO3-)+
(HCO3-)+![]() (H2CO3)=1.0
(H2CO3)=1.0
C. pH=7时,c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)=c(H+)
D. pH=10.3 时,c(Na+)+c(H+)=c(Cl-)+c(OH-)+3c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的有机化工原料,C02与H2在催化剂CZZA(普通铜基催化剂)作用下合成甲醇,相关反应如下:
反应Ⅰ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1 = -49.2kJ·mol-1
CH3OH(g)+H2O(g) △H1 = -49.2kJ·mol-1
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(g)=H2O(l) △H3 = -44.0kJ·mol-1
请回答:
(1)反应Ⅱ的△H2 =___________________kJ·mol-1。
(2)研究表明:在其他条件相同的情况下,将催化剂CZZA换成新型催化剂(CZZA/rGO),可以显著提高甲醇的选择性,试用过渡态理论解释其原因:___________________。
(3)以CZZA/rGO为催化剂,在一定条件下,将物质的量之比为1:3(总量为a mol)的C02与H2通入恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如下图所示:
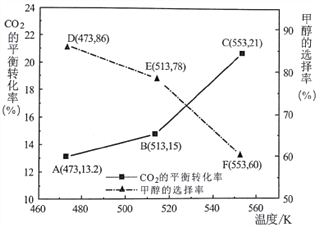
①在553K时,反应体系内甲醇的物质的量为___________________mol。
②随着温度的升高,C02的平衡转化率增加但甲醇的选择率降低,请分析其原因:__________________。
(4)将CO2与H2按物质的量之比为1:3通入恒温恒容密闭容器中,控制条件,使其仅仅按反应Ⅰ进行,得到甲醇的体积分数与时间的关系如上图2所示。保持其它条件不变,t1时再向容器中加入一定量物质的量之比为1:3的CO2与H2混合气,t2时再次达到平衡,请在下图中画出t1~t3时间内甲醇体积分数随时间的变化曲线。__________________

(5)在催化剂作用下,以NaOH溶液为电解液,将甲烷气体通入石墨复合电极,电解产生甲醇。写出阳极反应的电极反应式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学反应原理研究碳、硫及其化合物的性质具有重要意义。
(1)工业上用炭还原辉铜矿(主要成分是Cu2S),可制取金属铜。
己知反应的热化学方程式如下:
C(s)+S2(g)=CS2(g) △H1=150kJ/mol
Cu2S(s)+H2(g)=2Cu(s)+H2S(g) △H2=59.5kJ/mol
2H2S(g)=2H2(g)+S2(g) △H3=170kJ/mol
通过计算,可知用炭还原Cu2S制取金属铜和CS2(g)的热化学方程式为_________。
(2)为研究反应2H2S(g)![]() 2H2(g)+S2(g)对上述工业过程的影响,兴趣小组进行如下探究:
2H2(g)+S2(g)对上述工业过程的影响,兴趣小组进行如下探究:
①向三个体积均为1L的恒容密闭容器中分别加入1molH2S,进行H2S分解实验。不同温度下测得H2S的转化率与时间的关系如下图所示:
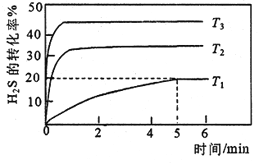
T1温度下,0~5minS2(g)的平均反应速率v(S2)= _____mol.L-1.min-1,反应平衡常数K=_____mol.L-1。温度T1、T2、T3由高到低的顺序是________。
②T4温度时,向1L的恒容密闭容器中加入1.8molH2(g)、1.2molS2(g),达到平衡后测得S2(g)和H2S(g)的浓度相等,则T4______T1(填“<”、“=”或“>”)。
(3)T℃时,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中三种微粒H2C2O4、HC2O4-、C2O42-的物质的量分数(δ)与pH的关系如下图所示:

①草酸的电离常数分别为K1与K2,则![]() =______。
=______。
②按投料比n(Na2C2O4):n(NaHC2O4)=2:1配成溶液,下列有关该溶液的叙述正确的是____(填序号)。
A. 该溶液的pH为4.2
B. 3c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)
C. 3c(Na+)=5[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]
D. 3c(OH-)+c(C2O42-)=3c(H+)+2c(HC2O4-)+5c(H2C2O4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com