
 2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是( )
2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是( )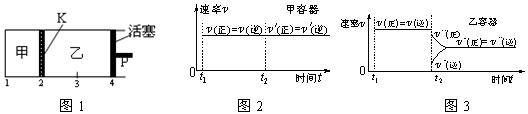
| A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 |
| B.保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 |
| C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
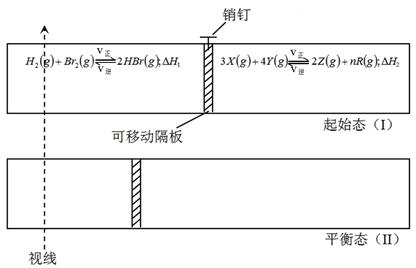
| D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
科目:高中化学 来源:不详 题型:填空题
 2SO3(g) ;△H<0。在2L恒容的密闭容器中,加入3molSO3(g)和lmol氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.6mol·L-1,当反应到8min时,反应到达平衡,此时c(SO3)=a mol·L-1。
2SO3(g) ;△H<0。在2L恒容的密闭容器中,加入3molSO3(g)和lmol氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.6mol·L-1,当反应到8min时,反应到达平衡,此时c(SO3)=a mol·L-1。| A.1、2、2 | B.3、1.5、1 | C.3、0、0 | D.0、6、5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物 质 | H2 | Br2(g) | HBr | X | Y | Z | R |
| 物质的量(mol) | 2.0 | 2.0 | 5.0 | 设x | 8.0 | 0.50 | 1.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| I A | II A | III A | IV A | V A | VI A | VII A | ||
| 2 | ② | ③ | ④ | | ⑤ | ⑥ | | ||
| 3 | ⑦ | ⑧ | ⑨ | | ⑩ | 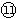 | 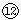 |
 的氢化物的还原性______稳定性 (填强或弱)
的氢化物的还原性______稳定性 (填强或弱)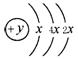 ,在周期表位于 。该
,在周期表位于 。该 与⑧形成化合物形成过程: 。
与⑧形成化合物形成过程: 。 的最高价氧化物对应水化物反应的离子方程式:
的最高价氧化物对应水化物反应的离子方程式: 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
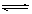 2NH3(g),达到平衡的标志是
2NH3(g),达到平衡的标志是| A.NH3的生成速率与H2的生成速率相等 | B.混合气体的密度不再发生变化 |
| C.N2、H2、NH3的分子数之比为1∶3∶2 | D.N2的转化率不再发生改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g),下列叙述不能表明它达到化学平衡的是
2C(g),下列叙述不能表明它达到化学平衡的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g);ΔH<0.下列结论中正确的是
2SO3(g);ΔH<0.下列结论中正确的是| A.若温度不变,将容器的体积增大一倍,此时的SO2浓度变为原来的0.48倍 |
| B.若平衡时SO2、O2的转化率相等,说明反应开始时,两者的物质的量之比为2:1 |
| C.若从平衡体系中分离出SO3,则有利于提高SO2的转化率和加快正反应速率 |
| D.平衡状态时SO2、O2、SO3的物质的量之比一定为2:1:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO(g)+H2(g)一定达平衡状态的是 ( )
CO(g)+H2(g)一定达平衡状态的是 ( )| A.气体的压强不变 |
| B.气体的体积不变 |
| C.混合气的密度不变 |
| D.有n个H—O键断裂的同时有n个H—H键断裂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com