
| A、强电解质都是离子化合物,弱电解质都是共价化合物 |
| B、NH3的水溶液能导电,所以NH3为电解质 |
| C、强电解质溶液的导电能力一定大于弱电解质溶液 |
| D、CaCO3在水中的溶解性小,但溶解的部分完全电离,故CaCO3是强电解质 |


科目:高中化学 来源: 题型:
| A、①>②>③>③ |
| B、①>②>④>③ |
| C、①=②>③>④ |
| D、①=②>③=④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、单质
| ||||||
| B、硅不能与任何金属反应 | ||||||
| C、陶瓷、玻璃、水泥都含有硅酸盐,属于传统的无机非金属材料 | ||||||
| D、单质硅常用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖中 | 固体变黑膨胀 | 浓硫酸有脱水性和强还原性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 将一小块Na放入稀盐酸中 | 缓慢产生气泡 | Na不易与盐酸反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显 紫红色 | 氧化性:Fe3+>I2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去CO2气体中的HCl:通过足量的饱和碳酸钠溶液 |
| B、除去粗盐中少量的MgCl2:溶解后,加入过量的NaOH溶液,过滤后加适量的盐酸,蒸干 |
| C、除去FeCl2溶液中的FeCl3:加入足量的铜粉,过滤 |
| D、除去Al2O3中的少量SiO2:加入足量的NaOH溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 点燃 |
| 高温 |
| 高温 |
| A、②③ | B、①④ |
| C、②③④ | D、只有② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、定容时仰视容量瓶的标线 |
| B、把烧碱固体放在纸上称量 |
| C、未冷却就将溶液转移至容量瓶 |
| D、使用的NaOH在空气中部分变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
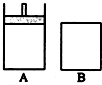 A容器是能 保持恒压的密闭容器,有一个能移动的活塞.B容器是保持恒容的密闭容器(如图所示),开始时,向A和B容器中分别充入2mol SO2 与1mol O2的混合气体,并且使A与B的容积相等,在一定温度下反应:2SO2(g)+O2(g)?2SO3(g)+Q(Q>0).
A容器是能 保持恒压的密闭容器,有一个能移动的活塞.B容器是保持恒容的密闭容器(如图所示),开始时,向A和B容器中分别充入2mol SO2 与1mol O2的混合气体,并且使A与B的容积相等,在一定温度下反应:2SO2(g)+O2(g)?2SO3(g)+Q(Q>0).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com