
 化合物AX3和单质X2在一定条件下反应可生成化合物AX5,该反应不能彻底.回答下列问题:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5,该反应不能彻底.回答下列问题:分析 (1)根据熔沸点判断出常温下各物质聚集状态,注明聚集状态与反应热书写热化学方程式;
(2)①用α表示AX3的平衡转化率,则参加反应AX3为0.2α mol,则:
AX3(g)+X2(g)?AX5(g)
起始(mol):0.2 0.2 0
转化(mol):0.2α 0.2α 0.2α
平衡(mol):0.2(1-α) 0.2(1-α) 0.2α
相同温度体积下,压强之比等于其物质的量之比,据此列方程计算α的表达式;
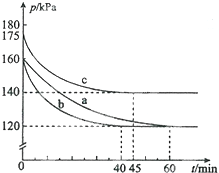
由图可知,实验c中$\frac{p}{{p}_{0}}$=$\frac{140}{175}$,代入α的表达式计算;
若在实验a中再加入0.1mol AX5,等效为增大压强,等效后平衡向正反应方向移动,再次达平衡后AX3的平衡转化率将增大;
②可逆反应到达平衡时,正逆反应速率相等,各组分的含量、浓度保持不变,由此衍生其它一些物理量不变,注意选择判断平衡的物理量应随反应进行发生变化,当该物理量由变化到不变化,说明到达平衡;
③由图可知,实验a在60min时到达平衡,平衡时AX3的α=2(1-$\frac{p}{{p}_{0}}$)=2×(1-$\frac{120}{160}$)=50%,则参加反应AX3的物质的量为0.2mol×50%=0.1mol,根据方程式可知生成AX5的物质的量,再根据v=$\frac{△c}{△t}$计算v(AX5;
④由于恒温恒容下,压强之比等于气体物质的量之比,故相同时间内压强变化量越大,反应速率越快;
实验a、b相比,起始压强相等,平衡时压强不变,改变条件不影响平衡移动,但b到达平衡的时间较短,反应速率较快,由于反应前后气体的体积减小,b应是使用催化剂;
a、c相比c组的反应速率加快,平衡时c的压强变化相对较小,说明与a相比,平衡逆向移动,说明是温度升高;
正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,而c组的温度高于a组;
c组平衡时,AX3的平衡转化率αc为40%,平衡常数K=$\frac{c(A{X}_{5})}{c(A{X}_{3})×c({X}_{2})}$=$\frac{n(A{X}_{5})}{n(A{X}_{3})×n({X}_{2})}$×V=($\frac{0.2α}{0.2(1-α)×0.2(1-α)}$×10)L/mol,代入数据计算.
解答 解:(1)因为AX3的熔点和沸点分别为-93.6℃和76℃,AX5的熔点为167℃,则室温时,AX3为液态,AX5为固态,生成1mol AX5,放出热量123.8kJ,该反应的热化学方程为:AX3(l)+X2(g)=AX5(s)△H=-123.8kJ•mol-1,
故答案为:AX3(l)+X2(g)=AX5(s)△H=-123.8kJ•mol-1;
(2)用α表示AX3的平衡转化率,则参加反应AX3为0.2α mol,则:
AX3(g)+X2(g)?AX5(g)
起始(mol):0.2 0.2 0
转化(mol):0.2α 0.2α 0.2α
平衡(mol):0.2(1-α) 0.2(1-α) 0.2α
相同温度体积下,压强之比等于其物质的量之比,故0.4:[0.2(1-α)+0.2(1-α)+0.2α]=P0:P,整理得:α=2(1-$\frac{p}{{p}_{0}}$),
由图可知,实验c中$\frac{p}{{p}_{0}}$=$\frac{140}{175}$,则 AX3的平衡转化率αc为2×(1-$\frac{140}{175}$)=40%,
若在实验a中再加入0.1mol AX5,等效为增大压强,等效后平衡向正反应方向移动,再次达平衡后AX3的平衡转化率将增大,
故答案为:α=2(1-$\frac{p}{{p}_{0}}$);40%;增大;
②A.混合气体总质量不变,随反应进行总物质的量增大,平均相对分子质量减小,混合气体的平均相对分子质量保持不变,说明反应到达平衡,故A正确;
B.混合气体总质量不变,容器体积不变,混合气体密度始终保持不变,不能说明到达平衡,故B错误;
C.X2的体积分数保持不变,说明到达平衡,故C正确;
D.每消耗1mol AX3的同时消耗1mol AX5,则消耗1mol AX5的同时生成1molAX3,AX3的生成速率与消耗速率相等,反应到达平衡,故D正确,
故选:B;
③由图可知,实验a在60min时到达平衡,平衡时AX3的α=2(1-$\frac{p}{{p}_{0}}$)=2×(1-$\frac{120}{160}$)=50%,则参加反应AX3的物质的量为0.2mol×50%=0.1mol,由方程式可知生成AX5的物质的量为0.1mol,故v(AX5)=$\frac{\frac{0.1mol}{10L}}{60min}$=0.00017mol/(L•min ),
故答案为:0.00017;
④由于恒温恒容下,压强之比等于气体物质的量之比,故相同时间内压强变化量越大,反应速率越快,由图可知,从开始到平衡时a、b、c压强分别为40kPa、40kPa、35kPa,所用时间分别为60min、40min、45min,每分钟内压强平均变化分别为$\frac{40}{60}$Pa、$\frac{40}{40}$Pa、$\frac{35}{45}$Pa,故反应速率b>c>a;
实验a、b相比,起始压强相等,平衡时压强不变,改变条件不影响平衡移动,但b到达平衡的时间较短,反应速率较快,由于反应气体气体的体积减小,b应是使用催化剂;
a、c相比c组的反应速率加快,平衡时c的压强变化相对较小,说明与a相比,平衡逆向移动,说明是温度升高;
正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,而c组的温度高于a组,故平衡常数Ka>Kc;
c组平衡时,AX3的平衡转化率αc为40%,平衡常数K=$\frac{c(A{X}_{5})}{c(A{X}_{3})×c({X}_{2})}$=$\frac{n(A{X}_{5})}{n(A{X}_{3})×n({X}_{2})}$×V=($\frac{0.2α}{0.2(1-α)×0.2(1-α)}$×10)L/mol=($\frac{0.2×0.4}{0.2(1-0.4)×0.2×(1-0.4)}$×10)L/mol=55.6L/mol,
故答案为:b>c>a;加入催化剂;升高温度;>;55.6L/mol.
点评 本题考查化学平衡计算,过程复杂且为字母型计算,属于易错题目,是对学生综合能力的考查,需要学生具备扎实的基础,题目难度较大.


科目:高中化学 来源: 题型:解答题
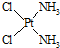 )中的Pt的化合价为+2.
)中的Pt的化合价为+2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. +
+ $\stackrel{H+}{?}$
$\stackrel{H+}{?}$ +(2n-1)CH3OH;G的同分异构体有多种,则满足下列条件的共有12种.
+(2n-1)CH3OH;G的同分异构体有多种,则满足下列条件的共有12种. 合成
合成 的流程图(写出反应物和反应条件).注:书写格式参照如下示例流程图:
的流程图(写出反应物和反应条件).注:书写格式参照如下示例流程图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
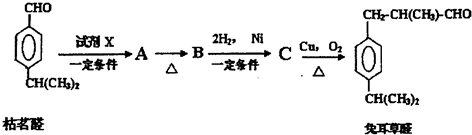
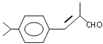 ;检验B中的官能团时,需先加入的试剂是新制氢氧化铜悬浊液;酸化后,再加入的试剂是溴水或高锰酸钾溶液.
;检验B中的官能团时,需先加入的试剂是新制氢氧化铜悬浊液;酸化后,再加入的试剂是溴水或高锰酸钾溶液. .
.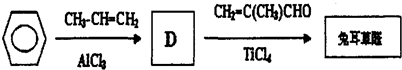
 .D→兔耳草醛的反应类型是加成反应.
.D→兔耳草醛的反应类型是加成反应. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
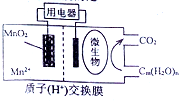 如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )| A. | 分子组成为Cm(H2O)n的物质一定是糖类 | |
| B. | 正极反应式为:MnO2+4H++2e-=Mn2++2H2O | |
| C. | 放电过程中,H+从正极区移向负极区 | |
| D. | 若Cm(H2O)n是葡萄糖,当电路中转移了6NA电子时,反应的葡萄糖质量是60g. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
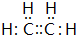 ,A的结构简式H2C=CH2.
,A的结构简式H2C=CH2. ,写出B的一种含三键且无支链的链烃的结构简式CH≡C-CH=CH-CH=CH2.
,写出B的一种含三键且无支链的链烃的结构简式CH≡C-CH=CH-CH=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
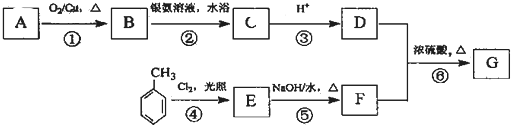
 ;
; .
.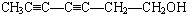 或
或 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com