
����Ŀ�����з�Ӧ��mA(g)��nB(g)![]() pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C������������С����
pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C������������С����
(1)�÷�Ӧ������ӦΪ________�ȷ�Ӧ����m��n________p������������������������������
���¸�������������������С������������
(2)�����������ƽ��ʱ��������������ʵ���________��
(3)������������B����A��ת����________��B��ת����________��
(4)��ѹʱ��A����������________����ѹʱ��B����������________��
(5)�������¶ȣ���B��Ũ��________��ƽ��ʱB��C��Ũ��֮��![]() ��________��
��________��
(6)��B����ɫ���ʣ�A��C����ɫ�������C(�������)�ﵽ��ƽ��ʱ�������ɫ________����ѹǿ���䣬�����C�ﵽ��ƽ��ʱ�������ɫ________��������������������dz��������������
���𰸡��� �� ���� ���� ��С ���� ��С ��С ��С ���� ��dz
��������
�ﵽƽ��������¶�ʱ��B��ת���ʱ��˵���¶�����ƽ��������Ӧ�����ƶ���������Ӧ���ȣ�����Сѹǿʱ�������ϵ��C����������Ҳ��С��˵����Сѹǿ��ѧƽ�����淴Ӧ�����ƶ�����ʽ�з�Ӧ�������ļ�����֮�ʹ�������������Ļ�ѧ������֮�ͣ�������������Ի�ѧƽ���Ӱ������⡣
(1)�����¶ȣ�B��ת���ʱ��˵�������¶Ȼ�ѧƽ��������Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ������Сѹǿʱ�������ϵ��C������������С��˵��ѹǿ��С��ѧƽ�����淴Ӧ�����ƶ�������ƽ���ƶ�ԭ������Сѹǿ����ѧƽ���������������ķ����ƶ����淴ӦΪ�����������ķ�Ӧ����������m+n��p��
(2)����ֻ�ܼӿ췴Ӧ���ʣ�������ʹ��ѧƽ�ⷢ���ƶ�����������������ƽ��ʱ��������������ʵ������䣻
(3)����������������䣬����B���ʣ�����B�Ƿ�Ӧ�����Ӧ��Ũ�ȣ���ѧƽ�������ƶ���A��ת��������B��ת����ȴ��С��
(4)����Сѹǿʱ�������ϵ��C����������Ҳ��С��˵����Сѹǿ��ѧƽ�����������������淴Ӧ�����ƶ������A�������������� ����ѹǿ����ѧƽ�������������С������Ӧ�����ƶ�����˴ﵽƽ��ʱB�������������С��
(5)�÷�Ӧ������ӦΪ���ȷ�Ӧ����������������ʱ�������¶ȣ���ѧƽ�������ȵ�����Ӧ�����ƶ�����������¶ȣ�B��Ũ�Ȼ��С��C��Ũ�Ȼ������ﵽƽ��ʱ���ߵ�Ũ��֮��![]() ��С��
����
(6)��B����ɫ���ʣ�A��C����ɫ�������C(�������)ʱ����ѧƽ�������ƶ���B��Ũ�����ӣ�ʹ�������ɫ�����ά��������ѹǿ���䣬����C����ʱ���������ݻ������ӣ�ʹB��Ũ�ȼ�С������������ɫ��dz��


 ����������������ϵ�д�
����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��л��������������ȷ����(����)
A. CH2===CH��CH===CH21��3������ϩ
B.  3������
3������
C.  ������
������
D.  2��������
2��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A ���������Ƿ��͵õ���Ҳ���Դ�ţ������ȡ��������A Ϊ��ɫճ��Һ�壬������ˮ��Ϊ�о�A�������ṹ������������ʵ�飺
ʵ�鲽�� | ���ͻ�ʵ����� |
��1����ȡA9.0g�������������������ܶ�����ͬ������H2��45 ���� | ��ͨ��������գ� |
��2����9.0gA��������O2�г��ȼ�գ���ʹһ��������λ���ͨ��Ũ���ᡢ��ʯ�ң��������߷ֱ�����5.4g��13.2g | ��2��A�ķ���ʽΪ__________�� |
��3����ȡA9.0g����������NaCO3��ĩ��Ӧ������2.24LCO2(��״��)���������������Ʒ�Ӧ������2.24LH2(��״��)�� | ��3��д��A�����������ŵ�����______�� |
( 4 ) A �ĺ˴Ź�����������ͼ�� | ( 4 ) A�к���______����ԭ�� |
��5������������A�Ľṹ��ʽΪ___________ | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��ӦaA��g��+bB��g�� cC��g����H = Q ���ܱ������н��У��ڲ�ͬ�¶ȣ�T1 �� T2 ����ѹǿ��P1 �� P2 ���£���������� B ���������� w��B���뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ�������ж���ȷ���� �� ��
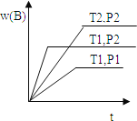
A.T1��T2��P1��P2��a+b��c��Q��0
B.T1��T2��P1��P2��a+b��c��Q��0
C.T1��T2��P1��P2��a+b��c��Q��0
D.T1��T2��P1��P2��a+b��c��Q��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��һ�ֹ��ʹ��ϵİ�ȫ��������ɫ���������е�11�棬���̵�-59�档��ҵ�ϣ���������ԭ���Ʊ�ClO2(Һ�෴Ӧ)��![]() ����NA�ǰ���٤��������ֵ������˵����ȷ����( )
����NA�ǰ���٤��������ֵ������˵����ȷ����( )
A.�ڱ�״���£�2240mL ClO2����ԭ����Ϊ0.3NA
B.������1.5mol Na2SO4����Ӧ�����Һ��Fe3+��ĿΪ0.2NA
C.48.0g FeS2��ȫ��Ӧ����������Ӧ��ת�Ƶ�����Ϊ6NA
D.ÿ����30mol NaClO3�����ɵ�ˮ����������ĿΪ14NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ���ҹ�ʹ�õ���Դ��Ҫ��ú��ʯ�͡���Ȼ���ȣ���Щ��Դ���Dz�����������Ⱦ��������Դ���о��Ϳ�����������֮���ߵ���Դ��δ����չ����Ҫ����ѧ��Ԥ�����ܽ���21���������������Դ֮һ��
(1)Ϊ����Ч��չ��������Դ�����ȱ����Ƶ����۵����������пɹ������ֽϾ�������Դ�ɳ������õ��������ķ�����________������ţ���
A.���ˮ B.п��ϡ���ᷴӦ C.��⺣ˮ
(2)�Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ����
��֪��![]()
![]()
![]()
![]()
�ɼ�����������һ��ȱ����________��
(3)��![]() �����ȷֽ�Ҳ�����Ƶ�����
�����ȷֽ�Ҳ�����Ƶ�����![]()
![]() ���ȷֽ�������ʱ������Ӧ����ͨ��һ�������Ŀ�����ʹ����
���ȷֽ�������ʱ������Ӧ����ͨ��һ�������Ŀ�����ʹ����![]() ȼ�գ���Ŀ����_________________________��
ȼ�գ���Ŀ����_________________________��
(4)þ���Ͻ�![]() ����һ��DZ�ڵ�������ϣ�������������£���һ����ѧ�����ȵ�
����һ��DZ�ڵ�������ϣ�������������£���һ����ѧ�����ȵ�![]() ��
��![]() ������һ���¶���������á��úϽ���һ����������ȫ����ķ�Ӧ����ʽΪ
������һ���¶���������á��úϽ���һ����������ȫ����ķ�Ӧ����ʽΪ![]() �õ��Ļ����
�õ��Ļ����![]() ��һ�������¿��ͷų�������
��һ�������¿��ͷų�������
�������Ʊ�þ���Ͻ�![]() ��ʱͨ�������Ŀ����____________________________________��
��ʱͨ�������Ŀ����____________________________________��
����������![]() ��
��![]() ��Һ�У������Y����ȫ�ͷų�
��Һ�У������Y����ȫ�ͷų�![]() ��
��![]()
![]() ��ȫ�����õ��Ļ����Y������������ȫ��Ӧ���ͷų�
��ȫ�����õ��Ļ����Y������������ȫ��Ӧ���ͷų�![]() �����ʵ���Ϊ________��
�����ʵ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ��ѡ��5���л���ѧ����]
���û�ѧ�����ϳ�ζ����·������ͼ��ʾ��
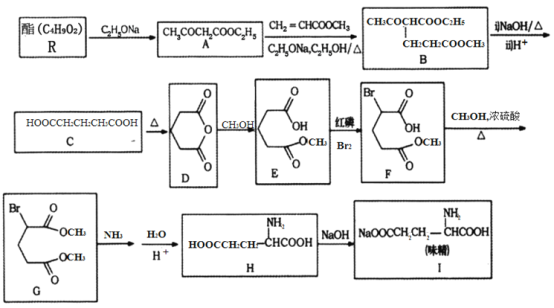
��ش��������⣺
(1)R�Ľṹ��ʽΪ________����A����B�ķ�Ӧ������________��
(2)F�к��������ŵ�����Ϊ________��������H�Ļ�ѧ����Ϊ________________��
(3)д����C����D�Ļ�ѧ����ʽ________________��
(4)д��һ�ַ�������Ҫ���A��ͬ���칹��Ľṹ��ʽ________��
�ٽṹ�к�����Ԫ�������ײⶨ��ʾ�����ӽṹ�в����ڼ���
������NaOH��Һ�з���ˮ�ⷴӦ��
��1mol����������������Na��Ӧ�ܹ�����0.5mol H2
(5)���������ϳ�·�ߣ�д���Ա�����(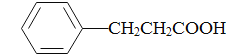 )�ͼ״�(�������Լ���ѡ)����ƺϳɱ�������(
)�ͼ״�(�������Լ���ѡ)����ƺϳɱ�������(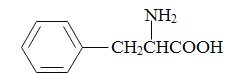 )��·�ߡ�_______________________________________________________________________
)��·�ߡ�_______________________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦN2O4��g��NO2��g����H=+57kJmol��1�����¶�ΪTʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ��Ϊ�� ��

A.A��C����ķ�Ӧ���ʣ�v��A����v��C��
B.A��C�����������ɫ��A�Cdz
C.B�����淴Ӧ���ʣ�v��������v���棩
D.A��C�������ݵ�ƽ����Է���������A��C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧѧ��![]() ��ѧ
��ѧ![]() ��֪ʶ��ó����н��ۣ�������ȷ���ǣ� ��
��֪ʶ��ó����н��ۣ�������ȷ���ǣ� ��
A.��NaH����ˮ���õ���ˮ��Һ�ܵ��磬�ɴ˿�˵��NaH�����ӻ�����
B.![]() �����
�����![]() �������������ʲ�ͬ����ѧ���ʻ�����ͬ
�������������ʲ�ͬ����ѧ���ʻ�����ͬ
C.![]() ��
��![]() ��
��![]() ��
��![]() �ȶ������������
�ȶ������������![]() ��MgO��
��MgO��![]() �ȶ��Ǽ���������
�ȶ��Ǽ���������
D.![]() ���н�ǿ�����ԣ�����Ϊ
���н�ǿ�����ԣ�����Ϊ![]() �ֽⷴӦ��������
�ֽⷴӦ��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com