
分析 (1)醋酸钠溶液中氢离子和氢氧根离子均为水电离的;醋酸钠溶液显示碱性,则c(H+)<c(OH-),结合电荷守恒可得:c(Na+)>c(CH3COO-);pH=3的醋酸,其浓度大于0.001mol/L,pH=11的氢氧化钠,其浓度等于0.001mol/L,等体积混合后,醋酸过量;根据电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),醋酸过量,溶液呈酸性,所以c(H+)>C(OH-);
(2)25℃时,向0.1mol/L的醋酸溶液中加入少量的醋酸钠固体,当固体溶解后,醋酸根离子增大抑制醋酸电离;
(3)①由醋酸根的物料守恒分析;
②由电荷守恒分析;
(4)加入醋酸,溶液中氢离子浓度增大,抑制了醋酸的电离;溶液为中性,则c(H+)=1.0×10-7mol/L,根据醋酸的电离平衡醋酸表达式:Ka=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$进行计算;
(5)结合c酸V酸=c碱V碱及实验操作进行误差分析.
解答 解:(1)醋酸钠溶液中氢离子和氢氧根离子均为水电离的,已知pH=11,则c(H+)=1×10-11 mol/L,所以水电离的c(OH-)=1×10-3 mol/L;醋酸钠溶液显示碱性,则c(H+)<c(OH-),结合电荷守恒可得:c(Na+)>c(CH3COO-),所以溶液中离子浓度大小c(Na+)>c(CH3COO?)>c(OH-)>c(H+);
pH=3的醋酸,其浓度大于0.001mol/L,pH=11的氢氧化钠,其浓度等于0.001mol/L,等体积混合后,醋酸过量,为醋酸和醋酸钠的混合溶液,则溶液显酸性,
醋酸过量,溶液呈酸性,所以c(H+)>C(OH-),根据电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(Na+)<c(CH3COO-),
故答案为:1×10-3 mol/L;c(Na+)>c(CH3COO?)>c(OH-)>c(H+);酸性;<;
(2)25℃时,向0.1mol/L的醋酸溶液中加入少量的醋酸钠固体,当固体溶解后,测得溶液的pH增大,醋酸钠溶解导致溶液中醋酸根离子浓度,抑制醋酸电离,溶液中氢离子浓度减小,则氢氧根离子浓度增大,PH增大;
故答案为:醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小;
(3)①由醋酸根的物料守恒可知,n(CH3COOH)+n(CH3COO-)=0.1mol,故答案为:CH3COOH;CH3COO-;
②由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-)+c(Cl-),则c(OH-)+c(CH3COO-)-c(H+)=c(Na+)-c(Cl-)=0.05mol/L,
故答案为:0.05;
(4)醋酸中存在CH3COO-+H2O?CH3COOH+OH-,溶液呈中性,则c(H+)=1.0×10-7mol/L,设混合后溶液的体积为VL,则c(Na+)=c(CH3COO-)=$\frac{a}{V}$mol/L,
则:$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$=2×10-5mol/L,所以c(CH3COOH)=$\frac{a}{2V}$×10-2mol/L,n(CH3COOH)=cV=$\frac{a}{2}$×10-2mol,则滴加醋酸的浓度为:$\frac{a}{200b}$mol/L,
故答案为:$\frac{a}{200b}$;
(5)A.未用标准液润洗碱式滴定管,则消耗的V碱偏大,则酸的浓度偏大,故A选;
B.滴定终点读数时,俯视滴定管的刻度,消耗的V碱偏小,则酸的浓度偏小,故B不选;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,酸的物质的量不变,对实验结果无影响,故C不选;
故答案为:A.
点评 本题考查酸碱混合的计算和定性分析,侧重学生分析能力及计算能力的考查,涉及盐类水解、酸碱混合、pH与浓度的关系等,注意电荷守恒和物料守恒的应用,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 此合金的熔点比镁和铝的熔点都高 | |
| B. | 此合金能全部溶解于稀盐酸中 | |
| C. | 此合金能全部溶解于氢氧化钠溶液中 | |
| D. | 此合金的硬度比镁和铝的硬度都大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
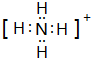 ,E分子的空间构型为三角锥形.
,E分子的空间构型为三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,0.2 molFe与足量水蒸气反应,生成的H2分子数目为$\frac{4}{15}$NA | |
| B. | 1molNa2O2固体中含离子总数为4NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④ | C. | ①②④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠 食盐 NaCl2 | B. | 碳酸氢钠 纯碱 NaHCO3 | ||
| C. | 氢氧化钙 熟石灰 CaO | D. | 氢氧化钠 火碱 NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、CO、CO2均为酸性氧化物 | |
| B. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2的质子数相同,互为同位素 | |
| C. | 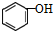 与 与 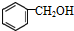 互为同系物 互为同系物 | |
| D. | 淀粉、纤维素和蛋白质都属于高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com