

| HCl |
| △ |
| O2/Cu |
| △ |
| 一定条件 |
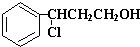 ,反应氧化反应生成Y为
,反应氧化反应生成Y为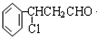 ,再在氢氧化钠醇溶液、加热条件下发生消去反应生成
,再在氢氧化钠醇溶液、加热条件下发生消去反应生成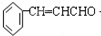 ,
,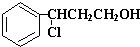 ,①苯环上只有两个处于对位的取代基,②能与FeCl3溶液发生显色反应,说明含有酚羟基,③分子中有连接四种不同原子或原子团的碳原子,以此解答;
,①苯环上只有两个处于对位的取代基,②能与FeCl3溶液发生显色反应,说明含有酚羟基,③分子中有连接四种不同原子或原子团的碳原子,以此解答;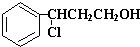 ,反应氧化反应生成Y为
,反应氧化反应生成Y为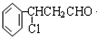 ,再在氢氧化钠醇溶液、加热条件下发生消去反应生成
,再在氢氧化钠醇溶液、加热条件下发生消去反应生成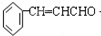 ,
,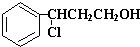 ,①苯环上只有两个处于对位的取代基,②能与FeCl3溶液发生显色反应,说明含有酚羟基,③分子中有连接四种不同原子或原子团的碳原子,则对应的同分异构体有
,①苯环上只有两个处于对位的取代基,②能与FeCl3溶液发生显色反应,说明含有酚羟基,③分子中有连接四种不同原子或原子团的碳原子,则对应的同分异构体有 ,
, ;
;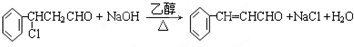 ,
, .
.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
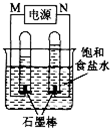 CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.
CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
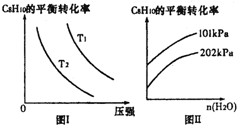 苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
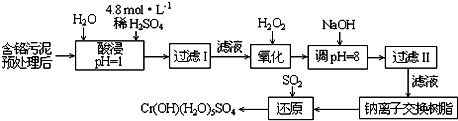
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
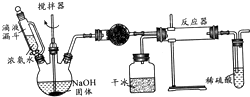 实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.
实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.查看答案和解析>>
科目:高中化学 来源: 题型:
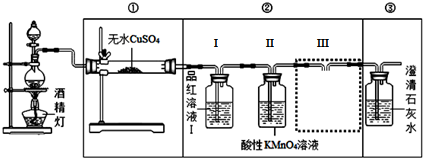
| 实验装置 | ① | ② | ③ |
| 实验现象 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
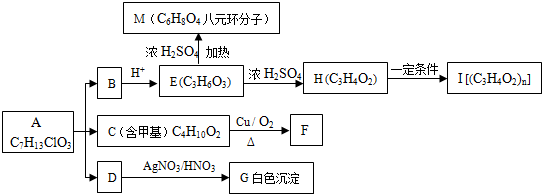
查看答案和解析>>
科目:高中化学 来源: 题型:
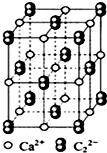 CaC2可用于固氮:CaC2+N2
CaC2可用于固氮:CaC2+N2
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用丙酮与盐酸的混合液作展开剂,对Fe3+与Cu2+用纸层析法分离时,Fe3+移动较快 |
| B、阿司匹林制备实验中,将粗产品加入饱和NaOH溶液中以除去水杨酸聚合物 |
| C、用瓷坩锅高温熔融NaOH和Na2CO3的固体混合物 |
| D、标准盐酸滴定待测NaOH溶液,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com