
【题目】下列离子方程式与所述事实相符且正确的是( )
A.用惰性电极电解熔融氯化钠:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-=Mn2++Cl2↑+2H2O
C.向Na[Al(OH)4]溶液中通入过量CO2制Al(OH)3:[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-
D.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
【答案】C
【解析】
A. 用惰性电极电解熔融氯化钠,生成Na和氯气,方程式为2NaCl![]() Cl2↑+2Na,与题意不符,A错误;
Cl2↑+2Na,与题意不符,A错误;
B. 用浓盐酸与MnO2在加热的条件下反应制取少量氯气:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,与题意不符,B错误;
Mn2++Cl2↑+2H2O,与题意不符,B错误;
C. 向Na[Al(OH)4]溶液中通入过量CO2生成Al(OH)3和碳酸氢根离子,方程式为[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-,符合题意,C正确;
D. Fe(OH)3溶于氢碘酸,生成的铁离子与碘离子反应生成亚铁离子和碘单质,2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,与题意不符,D错误;
答案为C。


 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】下列各情况,在其中Fe片腐蚀由快到慢的顺序是( )
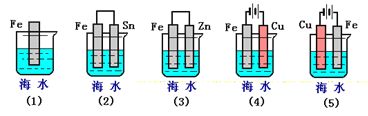
A. (5)(2)(1)(3)(4) B. (2)(5)(3)(4)(1)
C. (5)(3)(4)(1)(2) D. (1)(5)(3)(4)(2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙胺(CH3-CH2-NH2)极易挥发,溶于水、乙醇、乙醚等,可用于生产染料、医药和离子交换树脂等。将乙醇与氨气置于温度为350~400℃、压强为2.45~2.94MPa和催化剂为氧化铝的条件下反应可制备乙胺。

Ⅰ.氨气的制备
(1)用如图所示装置制备NH3。
①仪器A的名称是___。
②试剂X可能是CaO或__(填试剂名称),若选择CaO时,能产生NH3的原因是___。
Ⅱ.乙胺的制备与提纯
(2)乙胺的制备:
生成乙胺(CH3CH2-NH2)的化学方程式为___。(可不写反应条件)
(3)已知:制备过程中除了生成乙胺外,还会产生二乙胺、三乙胺、乙醚、乙氰和乙烯。

用如图装置提纯乙胺:

①提纯乙胺装置中的一处错误是___。
②冷凝管的冷水(10℃)由___(填“M”或“N”)口流出。
③错误纠正后蒸馏,收集___℃左右的馏分。
④冰水浴的作用是___。
(4)乙醇的密度为0.8g·cm-3,若取230.00mL无水乙醇,与过量氨气反应后,经提纯后得到142.02g乙胺,则乙胺的产率为__%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等浓度的NaOH溶液分别滴加到等pH、等体积的HA,HB两种弱酸溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述错误的是![]()
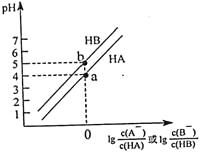
A.a、b两点,溶液中水的电离程度:![]()
B.电离平衡常数:![]()
C.a点时,![]()
D.向HA溶液中滴加NaOH溶液至中性时:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池,如图所示。
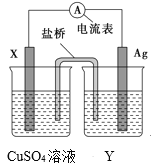
请回答下列问题:
(1)电极X的材料是___;电解质溶液Y是___。
(2)银电极为电池的___极,发生的电极反应为___。X电极上发生的电极反应为___。
(3)外电路中的电子是从____极流向___极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于溶液的酸碱性说法正确的是
A.含OH-的溶液一定呈碱性B.在100°C时,纯水的pH<7,因此显酸性
C.c(H+)=c(OH-)的溶液一定呈中性D.pH=14的溶液碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。下列说法正确是

A. 有MnO2条件下的反应曲线是a曲线
B. a曲线变为b曲线,反应的活化分子百分数增大
C. a曲线变为b曲线,平衡时H2O2的转化率增大
D. b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH= - ( E1 - E2)KJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次递增。其中A原子核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、C、D四种元素第一电离能最大的是_______________。
(2)B的氯化物的熔点比D的氯化物的熔点__________(填“高”或“低”),理由是_________________________。
(3)A的简单氢化物分子中的中心原子采取_______杂化,E的低价氧化物分子的立体构型是_______________。用KMnO4酸性溶液吸收该氧化物时,该反应的离子方程式为:_____________________________________________________________。
(4)F的核外电子排布式是___________,F的高价离子与A的简单氢化物形成的配离子的化学式为____________。
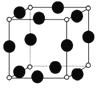
(5)A、F形成某种化合物的晶胞结构如图所示(其中A显-3价),若晶胞边长为a pm,阿伏伽德罗常数为NA,则该晶体的密度计算式为ρ=________________ g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用![]() 的
的![]() 溶液滴定
溶液滴定![]()
![]() 的
的![]() 溶液,水的电离程度随
溶液,水的电离程度随![]() 溶液体积的变化曲线如图所示。下列说法正确的是( )
溶液体积的变化曲线如图所示。下列说法正确的是( )

A.该滴定过程应该选择甲基橙作为指示剂
B.从![]() 点到
点到![]() 点,溶液中水的电离程度逐渐增大
点,溶液中水的电离程度逐渐增大
C.![]() 点溶液中
点溶液中![]()
D.![]() 点对应的
点对应的![]() 溶液的体积为
溶液的体积为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com