
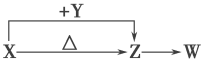
【题目】X、Y、Z、W四种化合物均由短周期元素组成。其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有如下图转化关系(部分反应物、产物及反应条件已略去)。请回答:
(1)Y的电子式是____________________。
(2)X与Y在溶液中反应的离子方程式是__________________________________________。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。
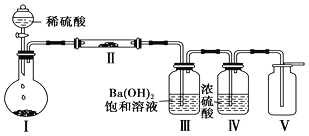
①装置Ⅰ中反应的化学方程式是_________________________________________________,装置Ⅱ中反应的化学方程式是________________________________________________。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是___________,所需仪器装置是_______________。 (从上图选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是__________________________________________________。
【答案】![]() HCO3—+OH-== CO32—+H2O Na2CO3+H2SO4 ==Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4==Na2SO4+2CO2↑+2H2O 2Na2O2+2CO2 == 2Na2CO3+O2 H2O2 Ⅰ、Ⅳ、Ⅴ 2Na2CO3+Cl2+H2O===NaClO+NaCl+2NaHCO3
HCO3—+OH-== CO32—+H2O Na2CO3+H2SO4 ==Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4==Na2SO4+2CO2↑+2H2O 2Na2O2+2CO2 == 2Na2CO3+O2 H2O2 Ⅰ、Ⅳ、Ⅴ 2Na2CO3+Cl2+H2O===NaClO+NaCl+2NaHCO3
【解析】
X、Y、Z的焰色反应均为黄色,说明三者均为钠元素的化合物.X含有四种元素,在加热条件下能生成Z,这四种化合物均为短周期元素组成,且W为无色无味的气体,可推出X是NaHCO3,则Z是Na2CO,W是CO2,Y是NaOH。
(1)NaOH属于离子化合物,据此写出其电子式;
(2)氢氧化钠与碳酸氢钠反应生成碳酸钠与水,据此写出其离子方程式;
(3)①X所含的四种元素为:Na、H、C、O,利用元素之间组成的化合物,制备并收集纯净干燥的无色气体R.R由组成X的四种元素中的一种组成,为气体单质,装置Ⅲ中产生白色沉淀,则装置Ⅰ中反应生成二氧化碳,在装置Ⅱ中反应生成气体单质R,应为二氧化碳与过氧化钠反应生成氧气,装置Ⅲ除去氧气中混有的二氧化碳,装置Ⅳ为干燥氧气,装置Ⅴ中收集的气体是氧气;据此进行分析;
②装置Ⅴ中收集的气体是氧气,氧气的制取也可以用双氧水和二氧化锰;将装置Ⅱ、Ⅲ去掉,分液漏斗中盛放过氧化氢,圆底烧瓶内盛放二氧化锰,据此分析。
(4)碳酸钠溶液和氯气反应生成的具有漂白、消毒作用的物质是 NaClO,还有碳酸氢钠、氯化钠,据此写出反应方程式。
X、Y、Z的焰色反应均为黄色,说明三者均为钠元素的化合物.X含有四种元素,在加热条件下能生成Z,这四种化合物均为短周期元素组成,且W为无色无味的气体,可推出X是NaHCO3,则Z是Na2CO,W是CO2,Y是NaOH。
(1)结合以上分析可知,NaOH属于离子化合物,电子式是![]() ;
;
综上所述,本题答案是:![]() 。
。
(2)碳酸氢钠与氢氧化钠溶液反应生成碳酸钠和水,离子方程式是:HCO3—+OH-== CO32—+H2O;
综上所述,本题答案是:HCO3—+OH-== CO32—+H2O。
(3) ①X所含的四种元素为:Na、H、C、O,利用元素之间组成的化合物,制备并收集纯净干燥的无色气体R.R由组成X的四种元素中的一种组成,为气体单质,装置Ⅲ中产生白色沉淀,则装置Ⅰ中反应生成二氧化碳,在装置Ⅱ中反应生成气体单质R,应为二氧化碳与过氧化钠反应生成氧气,装置Ⅲ除去氧气中混有的二氧化碳,装置Ⅳ为干燥氧气,装置Ⅴ中收集的气体是氧气;因此装置Ⅰ中的固体反应物是碳酸钠或碳酸氢钠,因此装置Ⅰ中发生的反应是: Na2CO3+H2SO4 ==Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4==Na2SO4+2CO2↑+2H2O;二氧化碳和过氧化钠反应生成氧气,饱和氢氧化钡溶液可除去二氧化碳,通过浓硫酸干燥后得到纯净的氧气,因此装置Ⅱ中物质的化学式是Na2O2;反应的方程式为:2Na2O2+2CO2 == 2Na2CO3+O2;
综上所述,本题答案是:Na2CO3+H2SO4 ==Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4==Na2SO4+2CO2↑+2H2O ;2Na2O2+2CO2 == 2Na2CO3+O2 。
②因为过氧化氢在二氧化锰等作催化剂的情况下,可以分解产生氧气,其反应装置需要Ⅰ(气体发生装置)、Ⅳ(干燥装置)、Ⅴ(收集装置);
综上所述,本题答案是:H2O2 ,Ⅰ、Ⅳ、Ⅴ。
(4) Z溶液是碳酸钠溶液,其和氯气反应生成的具有漂白、消毒作用的物质是 NaClO,除此以外,还有碳酸氢钠和氯化钠,因此该反应方程式为:2Na2CO3+Cl2+H2O===NaClO+NaCl+2NaHCO3;
综上所述,本题答案是:2Na2CO3+Cl2+H2O===NaClO+NaCl+2NaHCO3。


科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备及 A 中酒精灯已略)。
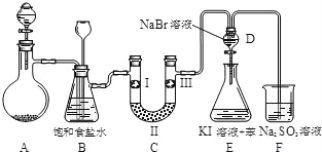
(1)实验室制氯气的离子方程式为_____。
(2)装置 B 中饱和食盐水的作用是_____;请写出装置 B 的另一个作用_______________________________。
(3)装置 C 的实验目的是验证氯气是否具有漂白性, 为此 C 中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是_______________(填编号)。
编号 | a | b | c | d |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置 D、E 的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置 D 中少量溶液加入装置 E 中,振荡,静置,观察到的现象是_____,该现象不能说明溴的非金属性强于碘,原因是_________。
(5)装置 F 中所发生的离子反应方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋白质的生理作用包括 ( )
①构成染色体 ②构成生物膜 ③是人体主要的能源物质 ④构成多种酶 ⑤组成所有激素 ⑥参与体液免疫过程
A. ①②③④B. ①②④⑤C. ②③④⑤D. ①②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
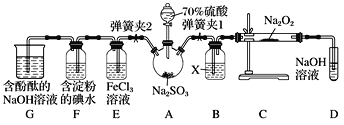
(1)在组装好装置后,若要检验A~D装置的气密性,其操作是首先__________,然后往D中装入水,然后微热A,观察到D中有气泡冒出,移开酒精灯或松开双手,D中导管有水柱形成且高度保持不变,说明装置气密性良好。
(2)装置D中盛放NaOH溶液的作用是___________。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明I-还原性弱于SO2的现象为_____;发生反应的离子方程式是________________。
(4)为了验证E中SO2与FeCl3发生了氧化还原反应,设计了如下实验:取E中的溶液,往溶液中加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀,说明SO2与FeCl3发生了氧化还原反应。
上述方案是否合理?________(填“合理”或“不合理”),原因是_____________。
(5)实验过程中G中含酚酞的NaOH溶液逐渐褪色,此实验证明SO2具有漂白性还是其溶于水显酸性?请设计实验验证:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种合成某药物中间体Z的方法如下。下列说法正确的是
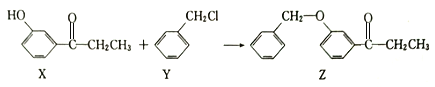
A. 1molX最多能消耗溴水中的2molBr2 B. Y可以发生消去反应
C. Z中所有碳原子可以在同一平面 D. 用FeCl3溶液可以检验Z中是否混有X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2A(g)![]() 2B(g)+E(g) ΔH>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
2B(g)+E(g) ΔH>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A. 加压 B. 升温 C. 减少E的浓度 D. 降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组以菱铁矿(主要成分为FeCO3,含有SiO2、Al2O3等少量杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的实验过程如下:

(1)酸溶及后续过程中均需保持算过量,其目的除了提高铁元素的浸出率之外,还有___________。
(2)操作Ⅰ名称是_______________。
(3)滴加H2O2溶液氧化时,发生主要反应的离子方程式为_________________。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在:_______________________。
(5)加入过量NaOH溶液的目的是__________________。
(6)请补充完整由过滤后得到的固体制备FeCl3·6H2O的实验方案:向过滤后所得固体______,用水洗涤固体2-3次,低温干燥,得到FeCl3·6H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、100 g 16.0%的的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
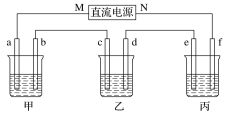
接通电源,经过一段时间后,测得丙中K2SO4的质量分数为12.20%,乙中c电极质量增加。据此回答问题:
(1)电源的N端为________极。
(2)电极b上发生的电极反应式为____________________________________________
(3)电极b上生成的气体在标准状况下的体积_________________。
(4)电极c的质量变化是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随lg![]() 的变化关系如图所示,下列叙述错误的是( )
的变化关系如图所示,下列叙述错误的是( )
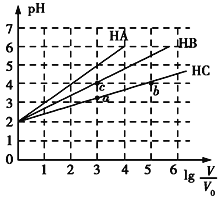
A. 常温下:Ka(HB)>Ka(HC)
B. HC的电离度:a点<b点
C. 当lg![]() =4时,三种溶液同时升高温度,
=4时,三种溶液同时升高温度,![]() 减小
减小
D. 当lg![]() =5时,HA溶液的pH为7
=5时,HA溶液的pH为7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com