
| A、第一周期 | B、第二周期 | C、第三周期 | D、第四周期 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
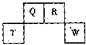 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?闸北区二模)某同学在研究前l8号元素时发现,可以将它们按原子序数递增的顺序排成如右图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.
(2012?闸北区二模)某同学在研究前l8号元素时发现,可以将它们按原子序数递增的顺序排成如右图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.| 共价键 | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 熔点 | 沸点 | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
| 元素 | X | F | |
| 电离能kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com