
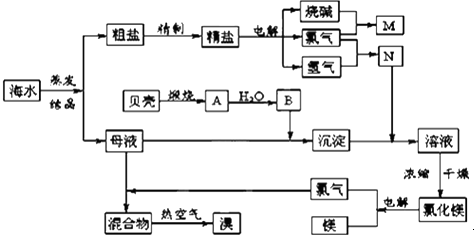
分析 海水通过蒸发结晶晒盐得到粗盐和母液,粗盐精制得到精盐溶解制备饱和溶液,通电电解得到氢氧化钠溶液、氯气、氢气,N为HCl,M为NaClO,贝壳煅烧得到氧化钙,溶于水得到氢氧化钙,加入母液沉淀镁离子生成氢氧化镁沉淀,加入盐酸溶解得到氯化镁溶液浓缩蒸发,冷却结晶得到氯化镁晶体,氯化氢气流中加热得到氯化镁,电解熔融氯化镁得到镁和氯气,氯气通过母液氧化溴离子为溴单质,通过热的空气吹出溴单质,C为Cl2,D为Mg.
(1)根据根据SO42-、Ca 2+、Mg2+等易转化为沉淀而被除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的溶液;
(2)Mg(OH)2中加入盐酸后,要获得MgCl2•6H2O晶体,需要进行的实验操作为:蒸发浓缩,冷却结晶.如果要使该晶体变为无水氯化镁,一定要在HCl气氛中脱水,否则会水解;(3)离子交换膜法电解饱和食盐水,电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;H2、NaOH在阴极,NaOH溶液的出口为阴极,Cl2在阳极生成,精制饱和食盐水从阳极进入;
(4)电解饱和食盐时,阳极:阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阴极:氢离子得到电子,据此书写反应方程式;
(5)利用MgCl2•6H2O可制得无水氯化镁,要在HCl气氛中脱水,否则氯化镁水解;
(6)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,发生的反应是亚硫酸钠被溴单质氧化为硫酸钠.
解答 解:(1)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,所以正确顺序为BDCA 或 CBDA 或BCDA等
故答案为:BDCA 或 CBDA 或BCDA等;
(2)Mg(OH)2中加入盐酸后,要获得MgCl2•6H2O晶体,需要进行的实验操作为:蒸发浓缩,冷却结晶.如果要使该晶体变为无水氯化镁,一定要在HCl气氛中脱水,否则会水解;
故答案为:DEC;
(3)目前工业上主要采用离子交换膜法电解饱和食盐水,电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;
总反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,阴极:氢离子放电,产生氢气.致使氢氧根离子浓度增大,钠离子和氢氧根离子的增大都发生在阴极室,所以阴极出口导出的液体是氢氧化钠溶液;阳极:氯离子放电,产生氯气,致使钠离子浓度升高,通过阳离子交换膜到达阴极室.所以阳极入口应加入精制饱和食盐水,
故答案为:D;
(4)电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;总离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
(5)氯化镁易水解,氯化氢可抑制其水解,利用MgCl2•6H2O可制得无水氯化镁,应采取的措施是:要在HCl气流中加热脱水,
故答案为:要在HCl气流中脱水.
(6)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,发生的反应是亚硫酸钠被溴单质氧化为硫酸钠,反应的化学方程式为:H2O+Na2SO3+Br2═Na2SO4+2HBr,
故答案为:H2O+Na2SO3+Br2═Na2SO4+2HBr.
点评 本题考查了电解池的工作原理知识,粗盐提纯的实验方案设计步骤及注意事项以及化学方程式的书写,化学来源于生产、生活,又服务于生产、生活,学习中注意积累化学知识,才能综合应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
 请在标有序号的空白处填空:
请在标有序号的空白处填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂、热的纯碱溶液 | B. | 硫黄、CS2 | ||
| C. | 水垢、食醋 | D. | 石蜡、蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
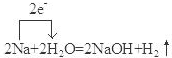 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2SO4溶于水中,所得溶液中Na+个数为NA | |
| B. | 1molCO2和NO2的混合物中含的氧原子数为4NA | |
| C. | 标准状况下,NA个CCl4分子所占的体积约为22.4L | |
| D. | 54g H2O中含有3NA个水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉水解的最终产物是葡萄糖 | |
| B. | 蛋白质只含有C、H、O三种元素 | |
| C. | 油脂在碱性条件下水解可制肥皂 | |
| D. | 葡萄糖与新制氢氧化铜悬浊液共沸有砖红色沉淀产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com