
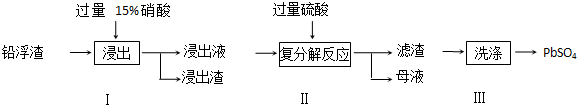
分析 (1)氧化铅属于碱性氧化物和硝酸反应生成盐和水,根据题给信息硝酸把铅氧化成Pb2+,硝酸被还原成NO,据此写出方程式;
(2)Pb2+完全转化成PbSO4沉淀离子浓度小于10-5mol/L,结合溶度积计算;
(3)Pb(NO3)2溶液加硫酸后生成硫酸铅沉淀和硝酸,过滤得滤液含硝酸;若母液中残留的SO42-过多,浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率;
(4)硫酸钙微溶,易沉淀在PbSO4表面,所以需用Pb(NO3)2溶液多次洗涤,除去CaSO4;
(5)充电过程中原电池的负极连接电源负极做电解池的阴极发生还原反应.
解答 解:(1)氧化铅属于碱性氧化物和硝酸反应生成盐和水,根据题给信息硝酸把铅氧化成Pb2+,硝酸被还原成NO,故反应方程式为PbO+2HNO3=Pb(NO3)2+H2O、3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O;
故答案为:PbO+2HNO3=Pb(NO3)2+H2O;3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O;
(2)Pb2+完全转化成PbSO4沉淀离子浓度小于10-5mol/L,Ksp(PbSO4)=1.6×10-8.则c(SO42-)=$\frac{Ksp}{1{0}^{-5}}$=$\frac{1.6×1{0}^{-8}}{1{0}^{-5}}$=1.6×10-3mol/L,
故答案为:1.6×10-3mol/L;
(3)Pb(NO3)2溶液加硫酸后生成硫酸铅沉淀和硝酸,所以母液可循环利用于步骤I,其溶质主要是HNO3,
若母液中残留的SO42-过多,浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率;
故答案为:HNO3;浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率;
(4)硫酸钙微溶,易沉淀在PbSO4表面,所以需用Pb(NO3)2溶液多次洗涤,除去CaSO4,离子方程式为:CaSO4+Pb2+=PbSO4+Ca2+,
故答案为:Pb(NO3)2,CaSO4杂质,CaSO4+Pb2+=PbSO4+Ca2+;
(5)充电过程中原电池的负极连接电源负极做电解池的阴极发生还原反应,电极反应为:PbSO4+2e-=Pb+2SO42-,故答案为:PbSO4+2e-=Pb+SO42-.
点评 本题考查了生产硫酸铅的工艺流程、硝酸的性质等,还涉及基本的实验操作,考查学生分析问题和解决问题的能力,题目难度中等.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:选择题
2012年6月16日我国成功发射了“神州九号”.这标志着中国人的太空时代又前进了一大步.发射“神九”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.已知:
N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7 kJ/mol
B.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1000.3 kJ/mol
C.N2H4(g)+NO2(g)=N2(g)+2H2O(l);△H=-1135.7 kJ/mol
D.2N2H 4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7 kJ/mol
4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
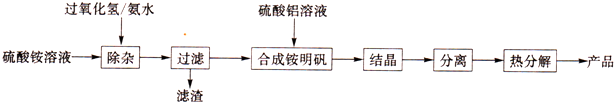
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
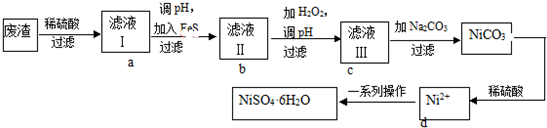
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
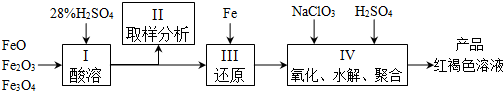
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:②>③>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:①>②>③ | D. | 最高正化合价:③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定某补血剂(成分FeSO4和维生素C)中铁元素的含量,将一定质量的补血剂溶于水,然后用标准浓度的酸性高锰酸钾溶液滴定至溶液恰好变紫色且半分钟不改变 | |
| B. | 测量SO2、N2混合气体中SO2含量,将标准状况下一定体积混合气体通过装有一定浓度一定体积的碘-淀粉溶液的反应直至溶液蓝色恰好消失 | |
| C. | 测定氯化铵与硫酸铵混合物中氯化铵的含量,将一定质量的混合物溶于水,再加入过量氯化钡溶液至沉淀不再生成,过滤、洗涤、干燥,再称重 | |
| D. | 测定硫酸铜晶体(CuSO4•xH2O)里结晶水的含量,将一定质量的硫酸铜晶体加热至蓝色变白,冷却,称量,重复至前后质量恒定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com