
| 6+2 |
| 2 |


科目:高中化学 来源: 题型:
| n(H2O) |
| n(CO) |
| | =1 | =3 | =5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
| n(H2O) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
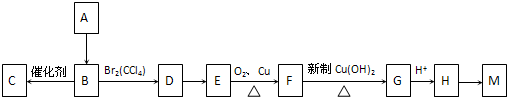
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W的金属性是同主族元素中最强的 |
| B、X、Z形成的化合物为离子化合物 |
| C、X最高价氧化物对应水化物的酸性大于Z的最高价氧化物对应水化物的酸性 |
| D、原子半径Y>Z,离子半径Y3+<Z2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 |
| B、某温度下,pH=6的蒸馏水显酸性 |
| C、氯气有毒,因而自来水的杀菌消毒一定不能使用氯气 |
| D、明矾可用于水的净化与杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH为9的Na2CO3溶液和pH为5的NaHSO4溶液中,水的离程度相同 |
| B、在含Al3+的KNO3溶液中,可通过加热法除去Al3+,证明盐的水解是吸热反应 |
| C、已知HF的酸性比HCN的酸性强,则等体积等浓度NaF和NaCN两溶液中阳离子的物质的量之和相等 |
| D、等物质的量浓度的①NH4Cl ②NH4HSO4 ③Na2S ④NaNO3 ⑤(NH4)2SO4,其pH由大到小的排列为③>④>⑤>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、MnO2+4HCl(浓)
| ||||
| B、Fe2O3+2Al═Al2O3+2Fe | ||||
| C、CaH2+2H2O═Ca(OH)2+2H2↑ | ||||
| D、3NO2+H2O═2HNO3+NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com