
【题目】对金属制品进行抗腐蚀处理,可减缓金属的腐蚀,延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
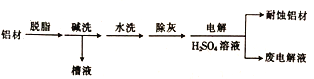
①碱洗的目的是除去铝表面的自然氧化膜(Al2O3),有关反应的离子方程式为_________________。碱洗时常有气泡冒出,该气体是_________ (填化学式)。
②电解时,处理好的铝材应与电源的________极相连,铝材表面形成氧化膜的电极反应式为_______。
(2)钢铁容易生锈的主要原因是钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在酸性环境下,其正极反应式为_________;在酸性很弱或中性条件下,其发生_______(填“析氢腐蚀”或“吸氧腐蚀”)。
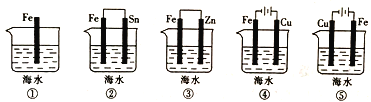
(3)下列装置中铁片腐蚀由快到慢的顺序是____________(用序号表示)。
(4)利用如图装置,可以模拟铁的电化学防护。
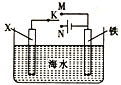
若X为碳棒,开关K置于N处,该电化学防护法称为______;若X为锌棒,开关K置于M处,_____(填“能”或“不能”)达到防止铁腐蚀的目的。
【答案】 Al2O3+2OH-=2AlO2-+H2O H2 正 2Al+3H2O-6e-==Al2O3+6H+ 2H+ +2e-=H2↑ 吸氧腐蚀 ⑤>②>①>③>④ 外加电流的阴极保护法 能
【解析】(1)①Al2O3是两性氧化物,与OH-反应生成AlO2-和H2O,离子方程式为:Al2O3+2OH-=2AlO2-+H2O;因为Al具有两性,能与OH-反应生成AlO2-和H2,所以碱洗时常有气泡冒出,该气体是H2。②要通过电解使处理好的铝材表面形成氧化膜,处理好的铝材应与电源的正极相连发生氧化反应,又根据酸性电解质溶液,所以电极反应式为:2Al+3H2O-6e-=Al2O3+6H+。
(2)在酸性环境下,钢铁易发生析氢腐蚀,H+在正极上得到电子生成H2,所以正极反应式为:2H++2e-=H2↑;在酸性很弱或中性条件下,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应,称为吸氧腐蚀。
(3)由图可知,①为化学腐蚀,②③装置是原电池,在②中,金属铁做负极,③中金属铁作正极,做负极的腐蚀速率快,并且两个电极金属活泼性相差越大,负极金属腐蚀速率越快,正极被保护,并且原电池原理引起的腐蚀>化学腐蚀,所以②>①>③,④⑤装置是电解池,④中铁为阴极,⑤中铁为阳极,阳极金属被腐蚀的速率快,阴极被保护,即⑤>④,根据电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀,并且原电池的正极金属腐蚀速率快于电解池的阴极金属腐蚀速率,所以铁腐蚀快慢顺序为:⑤>②>①>③>④。
(4)X为碳棒,开关K置于N处,形成电解池,铁作阴极被保护,该电化学防护法称为外加电流的阴极保护法;若X为锌棒,开关K置于M处,形成原电池,Zn作负极、铁作正极,能达到防止铁腐蚀的目的。


科目:高中化学 来源: 题型:
【题目】在制玻璃的原料中,再加入下列物质后,可制得各种不同用途的玻璃:
a.氧化亚铜(Cu2O) b.氧化钴(Co2O3)
c.氧化铅(PbO) d.硼砂(Na2B4O7·10H2O)
①制造化学仪器的玻璃需加入的物质是。
②制造光学仪器的玻璃需加入的物质是。
③制造蓝色玻璃需加入的物质是。
④制造红色玻璃需加入的物质是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关海水综合利用的说法正确的是
A. 海水中含有钾元素,只需经过物理变化就可以得到钾单质
B. 海水蒸发制海盐的过程中只发生了化学变化
C. 从海水中可以得到NaCl,电解熔融NaCl可制备Na和Cl2
D. 利用潮汐发电是将化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方案错误的是
选项 | 被提纯的物质 | 杂质 | 除杂试剂 |
A | FeCl3(aq) | Fe2+ | 新制氯水 |
B | FeCl2(aq) | Fe3+ | Cu粉 |
C | NaHCO3(aq) | Na2CO3 | CO2气体 |
D | Mg粉 | Al粉 | NaOH(aq)、过滤 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于非金属元素Si、N、S、Cl的叙述,正确的是
A. 通常情况下,它们的单质均为气体 B. 它们在自然界中都存在游离态的单质
C. 它们都有对应的含氧酸 D. 每种元素都只有一种氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一个10 L密闭容器中发生某可逆反应,其平衡常数表达式为K=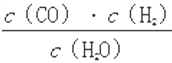 。请回答下列问题。
。请回答下列问题。
(1)若温度升高,K增大,则该反应是________反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是________(填字母序号)。
A.v正(H2O)=v逆(H2)
B.容器中气体的平均相对分子质量不随时间改变
C.消耗n mol H2的同时消耗n mol CO
D.容器中物质的总物质的量不随时间改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为了测定某(CuCl22H2O)样品的纯度,设计了如下方案:称取1.0 g样品溶解于适量水中,向其中加入含AgNO3 2.38 g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2 mol·L-1的KSCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定样品的纯度。请回答下列问题:
(1)判断滴定达到终点的现象是___________________。
(2)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果_____________(选填“偏高”、“偏低”或“无影响”)。
(3)若到达滴定终点时,用去KSCN标准溶液20.00mL,求此样品的纯度__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com