
【题目】化学工业中会产生大量含铬废水。需进行无害化处理检测达标后才能排放。
(1) 工业常用NaHSO3还原法处理,方法如下:向酸性废水中加入NaHSO3使Cr2O72-还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
写出NaHSO3与Cr2O72-反应的离子方程式:_______________________。
(2) 废水中铬元素总浓度的测定方法如下:向一定量含Cr2O72-和Cr3+的酸性废水样中加入足量(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O72-与I-完全反应生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系如下:Cr3+![]() Cr2O72-
Cr2O72-![]() I2
I2![]() S4O62-。
S4O62-。
①上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会____(填“偏大”、“偏小”或“不变”)。
②以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点时的现象为________。
③准确移取含Cr2O72-和Cr3+的酸性废水样100.00 mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000 mol·L-1Na2S2O3标准溶液13.50 mL。计算该废水中铬元素总浓度(以mg·L-1表示)(写出计算过程)__________。
【答案】3HSO3-+Cr2O72-+5H+=2Cr3++3SO42-+4H2O 偏大 溶液恰好由蓝色变成无色,且半分钟不恢复为原色 23.40mg/L
【解析】
(1)NaHSO3与Cr2O72-发生氧化还原,反应生成铬离子、硫酸根离子和水;
(2)①若无煮沸操作,则过量(NH4)2S2O8消耗Cr2O72-,所以则测定的铬元素总浓度会偏高;
②根据碘遇淀粉显蓝色,故滴定终点时的现象为蓝色变成无色,且半分钟不恢复为原色;
③根据流程以及反应的关系,进而确定关系式,可计算总浓度。
(1)转化时NaHSO3与Cr2O72-发生氧化还原,反应生成铬离子、硫酸根离子和水,反应的离子方程式为:Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O,故答案为:3HSO3-+Cr2O72-+5H+=2Cr3++3SO42-+4H2O。
(2)①若无煮沸操作,则过量(NH4)2S2O8消耗Cr2O72-,所以则测定的铬元素总浓度会偏大,故答案为:偏大。
②由于碘遇淀粉显蓝色,根据题中转化关系可知,当碘完全消耗完毕后蓝色消失,所以滴定终点时的现象是当滴入最后一滴Na2S2O3溶液后蓝色褪去,且半分钟不恢复为原色,故答案为:溶液恰好由蓝色变成无色,且半分钟不恢复为原色。
③涉及反应方程式为①2Cr3++3S2O82-+7H2O=Cr2O72-+6SO42-+14H+;②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;③I2+2S2O32-=2I-+S4O62-,由以上反应得到关系式为Cr2O72-~3I2~6S2O32-,消耗0.01000molL-1的Na2S2O3标准溶液13.50mL,则n(Na2S2O3)=0.01000molL-1×13.50×l0-3L=1.35×l0-4mol,则由关系式可知n(Cr2O72-)=1/6×1.35×l0-4mol=2.250×l0-5mol,n(Cr)=2(Cr2O72-)=4.500×l0-5mol,则废水样中铬元素总浓度=4.500×105mol×52g/mol×1000mg/g/100.00mL×103L/mL=23.40mgL-1,故答案为:23.40mgL-1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氮化锂(Li3N)常用作固体电解质和催化剂,遇水蒸气反应生成氢氧化锂和氨气,以一瓶氮气样品(含一氧化碳和氧气)制备纯净的氮化锂,其装置如图所示:
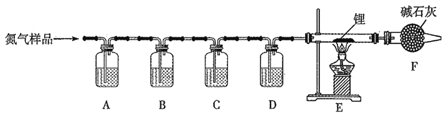
已知:连苯三酚的碱性溶液能吸收少量O2;氯化亚铜的盐酸溶液能吸收少量CO且易被O2氧化。请回答下列问题:
(1)选择下列试剂填入指定位置:
装置代号 | A | B | C | D |
试剂代号 | _____ | ______ | ____ | ____ |
![]() 浓硫酸
浓硫酸 ![]() 氯化亚铜的盐酸溶液
氯化亚铜的盐酸溶液
![]() 连苯三酚的碱性溶液
连苯三酚的碱性溶液 ![]() 氢氧化钠溶液
氢氧化钠溶液
(2)F装置的作用是______________。
(3)实验中,先通入氮气,后点燃酒精灯,目的是_____________。
(4)写出E中反应的化学方程式 ____________。
(5)设计如下装置测定产品纯度:称取a g产品于G烧瓶中,向安全漏斗中加入足量蒸馏水,收集到V mL气体(折合成标准状况)。
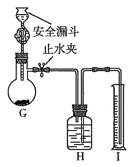
①安全漏斗的作用是______________________。
②H装置所装液体可能是________________![]() 填字母
填字母![]() 。
。
![]() 饱和氯化铵溶液
饱和氯化铵溶液 ![]() 煤油
煤油 ![]() 饱和食盐水
饱和食盐水 ![]() 苯
苯
③根据上述数据计算,该氮化锂产品纯度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 0.1 mol Fe在0.1 mol氯气中充分燃烧时转移的电子数为0.3NA
B. 0.1 mol乙烷和丙烯的混合物所含氢原子数目为0.6NA
C. 64 g的SO2与足量的O2充分反应后可得到NA个SO3分子
D. 标准状况下,2.24 L四氯化碳含有的分子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaC1O2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

(1)写出“反应”步骤中生成ClO2的化学方程式:______________。
(2) “电解”中阴极反应的主要产物是_______________________。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分別为______________溶液、______________溶液(填化学式)。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。写出“尾气吸收”的离子方程式:_______________________。此吸收反应中,氧化剂与还原剂的物质的量之比为________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____g(计算结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时部分弱电解质的电离平衡常数如下表所示:
化学式 | CH3COOH | H2CO3 | HClO | |
平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a. CH3COOH b. H2CO3 c. NaHCO3 d. HClO
pH由小到大的排列顺序是____(填字母)。
(2)常温下,0.1 mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是____(填字母)。
A. c(H+) B.![]() C. c(H+)·c(OH-) D.
C. c(H+)·c(OH-) D.![]() E.
E.![]()
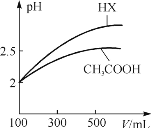
(3)体积均为100 mL、pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如下图所示,则HX的电离平衡常数____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是____。在上述体积、pH均相同的CH3COOH与一元酸HX中加入足量的锌,生成的氢气在相同情况的体积大小关系为:CH3COOH____(填“大于”、“小于”或“等于”)HX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。(已知:NH4HCO3=NH3↑+CO2↑+H2O)
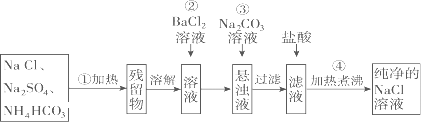
(1)操作②为什么不用硝酸钡溶液,其理由是_______________________________;
(2)进行操作②后,如何判断SO42-已除尽,方法是___________________________;
(3)操作③的目的是____________,其中涉及到的离子方程式是_______________;
(4)往滤液中加入盐酸的离子方程式是__________________________________;
(5)NH4HCO3在水溶液中的电离方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2NaHCO3![]() Na2CO3 + H2O+CO2 ,现把14.8g Na2CO310H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2molL﹣1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
Na2CO3 + H2O+CO2 ,现把14.8g Na2CO310H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2molL﹣1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
A. 6.36gB. 3.18gC. 4.22gD. 5.28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa。25℃时,几种弱酸的pKa值如下表所示。下列说法正确的是
弱酸的化学式 | CH3COOH | HCOOH | H2SO3 |
pKa | 4.74 | 3.74 | 1.90 7.20 |
A. 向Na2SO3溶液中加入过量乙酸,反应生成SO2
B. 25℃时,pH=8的甲酸钠溶液中,c( HCOOH)=9.9×10-7mol·L-1
C. 25℃时,某乙酸溶液pH=a,则等浓度的甲酸pH=a-1
D. 相同温度下,等浓度的 HCOONa溶液比Na2SO3溶液的pH大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 检验KIO3中的碘元素 | 取少量KIO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液 |
B | 检验石油裂解气中的乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
C | 比较HClO和CH3COOH的酸性强弱 | 室温下,用pH计测定饱和的NaClO溶液和饱和的 |
D | 硅酸胶体的制备 | 向 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com