
【题目】甲醇是一种化工原料,在工业生产中有重要的应用。
Ⅰ.在l.0L恒容密闭容器中投入1 molCO2和2.75molH2发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是_______。
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是_______。

A.该反应的正反应为放热反应
B.压强大小关系为pl<p2<p3
c. M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.甲醇是基本有机化工原料。甲醇及其可制得的产品的沸点如下。
名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
结构简式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH3 | (CH3O)2CO |
沸点/℃ | 64.7 | 7.4 | 153 | -24.9 | 90 |
(1)在425℃、Al2O3做催化剂,甲醇与氨气反应可以制得二甲胺。二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为____________。
(2)甲醇制甲醚的化学方程式为2CH3OH![]() CH3OCH3+H2O,一定温度下,在体积为1.0L的恒容密闭容器中发生该反应。己知387℃时该反应的化学平衡常数K=4,若起始时向容器I中充入0.10molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向______(填“正”或“逆”)反应方向进行。
CH3OCH3+H2O,一定温度下,在体积为1.0L的恒容密闭容器中发生该反应。己知387℃时该反应的化学平衡常数K=4,若起始时向容器I中充入0.10molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向______(填“正”或“逆”)反应方向进行。
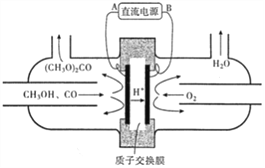
(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如下图所示。
电源的负极为__________(填“A”或“B”),写出阳极的电极反应_________;若参加反应的O2为1.12m3(标准状况),则制得的碳酸二甲酯的质量为______kg。
【答案】 AC c(Cl-)>c[(CH3)2NH![]() ]>c(H+)>c(OH-) 正 B 2CH3OH+CO-2e-===(CH3O)2CO+2H+ 9
]>c(H+)>c(OH-) 正 B 2CH3OH+CO-2e-===(CH3O)2CO+2H+ 9
【解析】Ⅰ、A.由图可知,随着温度升高,平衡时甲醇的物质的量在减小,所以升温平衡向逆反应方向移动,则正反应为放热反应,A正确;B.由图可知,作一条等温线,因为该反应为气体体积减小的反应,压强越大,平衡时甲醇的物质的量也越大,所以p1>p2>p3,B错误;C.由图可知,M点对应的甲醇产量为0.25mol,则
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
开始 1 2.75 0 0
反应 0.25 0.75 0.25 0.25
平衡 0.75 2 0.25 0.25
又体积为1.0L,所以K=0.25×0.25/0.75×23=1.04×10-2;C正确;D.由图可知,在p2及512 K时,N点甲醇的物质的量还小于平衡时的量,所以应该正向移动,则v(正)>v(逆),D错误;答案选AC;
Ⅱ、(1)二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,(CH3)2NH2+离子水解溶液显酸性,据此判断溶液中各离子浓度大小为:c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-);(2)已知387℃时该反应的化学平衡常数K=4。若起始时向容器I中充入0.10molCH3OH、0.15molCH3OCH3和0.10molH2O,浓度商Qc=0.15×0.1/0.12=1.5<K=4,则反应将向正反应进行;(4)图分析可知氢离子移向阴极,则与此电极连接的B电极为负极,阳极上是甲醇和一氧化碳反应失电子发生氧化反应,电极反应为:2CH3OH+CO-2e-=(CH3O)2CO+2H+,若参加反应的O2为1.12m3(标准状况),物质的量=1120L÷22.4L/mol=50mol,电子转移50mol×4=200mol,则制得碳酸二甲酯的质量=100mol×90g/mol=9000g=9.00kg。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是__________,充分反应后证明溶液中只存在Fe2+而不存在Fe3+的现象是__________________。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:______________________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
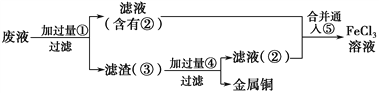
①滤渣③的主要成分是:__________。滤液②的主要成分是:__________。
②下列一定不适宜作为⑤的试剂的是__________。
A.Cl2 B.O2 C.H2O2 D.KMnO4
③写出反应④的离子方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式为 ![]() ,请回答下列问题:
,请回答下列问题:
(1)A中含氧官能团的名称是____;
(2)A可能发生的反应有_____(填序号);
①酯化反应 ②加成反应 ③消去反应 ④水解反应
(3)将A与氢氧化钠的乙醇溶液混合并加热,再让得到的主要产物发生加聚反应,生成了某聚合物,该聚合物的结构简式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 有机反应中常说的卤化、硝化、水化都属于取代反应
B. 按系统命名法,有机物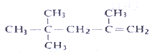 的名称为:2,2,4—三甲基—4—戊烯
的名称为:2,2,4—三甲基—4—戊烯
C. 分子式为C8H11N的有机物,分子内含有苯环和氨基(-NH2)的同分异构体共13种
D. 废旧钢材焊接前,分别用饱和Na2CO3、NH4Cl溶液处理焊点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇与浓硫酸共热制乙烯,常因温度过高生成少量SO2,有人设计了如下图所示实验,以验证上述混合气体中是否含有乙烯和SO2 。

(1)装置中X仪器的名称是____;碎瓷片的作用是____;
(2)写出生成乙烯的反应方程式____;
(3)A、B、C、D装置中可盛放的试剂是(从下列所给试剂中选出,填序号)
①NaOH溶液,②品红溶液,③KMnO4酸性溶液,④FeCl3溶液
A.___ B.___ C.___ D.___
(4)能说明SO2气体存在的现象是_______________;
(5)确证含有乙烯的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂中,可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3四种溶液的是
A. NaOH B. H2SO4 C. NH3·H2O D. AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们如何找到回家的路?荣获2014年诺贝尔生理学或医学奖的三位科学家发现大脑里的神经细胞——“位置细胞”和“网格细胞”起到了重要作用。下列叙述中正确的是
A. “位置细胞”鲜重中质量百分比最高的元素是C
B. “网格细胞”干重中质量百分比最高的元素是O
C. 上述两种细胞鲜重中原子数量最多的元素均是H
D. P和S分别是“位置细胞”中的大量元素和微量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中:①过滤;②蒸发;③溶解;④取液体试剂;⑤取固体试剂。一定要用到玻璃棒的是( )
A. ①②③ B. ④⑤
C. ①④ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钡的金属活动性处于钾和钠之间。则下列变化中可能实现的是
A. 钡可从氯化钠溶液中置换出金属钠
B. 钡可从冷水中置换出氢气
C. 钡可从硫酸铜溶液中置换出铜
D. 在溶液中Ba2+可氧化金属锌,生成Zn2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com