
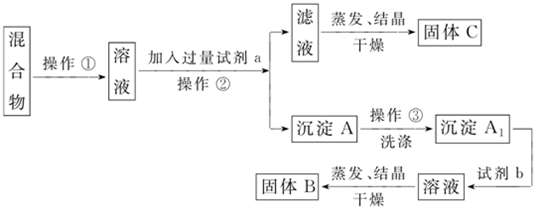
分析 (1)草木灰中的钾盐可以溶于水中形成溶液,可以利用过滤的方法来获得钾盐的水溶液,加热蒸发可得到晶体;
(2)玻璃棒可用于搅拌、引流等作用;
(3)碳酸根离子和盐酸反应产生气体,硫酸根离子和盐酸酸化钡离子反应生成白色沉淀;氯离子和硝酸酸化的银离子反应生成白色沉淀;
(4)根据天平平衡的原理可知,把样品放在右盘,砝码放在左盘,若指针偏向右边,则右边重.
解答 解:(1)草木灰中的钾盐可以溶于水中形成溶液,然后利用过滤的方法可以获得钾盐的水溶液,将所得的水溶液蒸发结晶可以获得氯化钾的固体,
故答案为:过滤;取滤液、蒸发滤液;
(2)在溶解固体时,使用玻璃棒可以加速溶解,在过滤操作中,可以用玻璃棒来引流,在蒸发结晶操作中,用玻璃棒来搅拌,使得受热均匀(防止液体飞溅),
故答案为:加速溶解;引流,防止液体溅到漏斗外;使溶液受热均匀,防止液体飞溅;
(3)①碳酸根离子能和盐酸反应生成二氧化碳,向溶液中加入稀盐酸后有气泡生成说明有碳酸根离子,发生反应:2H++CO32-=H2O+CO2↑,故答案为:气泡;CO32-;
②向原溶液中滴加盐酸酸化的氯化钡溶液,排除了其它阴离子的干扰,如果产生白色沉淀,就说明溶液中有硫酸根离子,涉及反应的方程式是2H++CO32-=H2O+CO2↑、SO42-+Ba2+=BaSO42-↓,故答案为:白色沉淀;SO42-;
③向原溶液中滴加足量稀硝酸后,排除了其它离子的干扰,再加入 AgNO3 溶液,产生白色沉淀,说明溶液中有氯离子,反应的离子方程式是:Cl-+Ag+=AgCl↓,故答案为:白色沉淀;Cl-;
(4)用托盘天平称量样品时,若指针偏向右边,则表示左盘轻、砝码重,故答案为:B.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的性质、离子检验及实验操作等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应制取H2后的溶液中:Na+、K+、AlO2-、Br- | |
| B. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | |
| C. | 苯酚钠溶液:H+、HCO3-、SO2、K+ | |
| D. | 氢氧化铝胶体:H+、K+、S2-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | 金属钠跟水反应:2Na+2H2O=2Na++2OH-+H2↑ | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ | |
| D. | 用醋酸除水垢(主要成分为碳酸钙):2H++CO32-=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃棒下端要靠在三层滤纸处 | |
| B. | 滤纸边缘低于漏斗边缘,多余部分要剪去,并用水润湿贴紧,不留气泡 | |
| C. | 过滤时将液体沿玻璃棒注入过滤器,并使液面高于滤纸边缘 | |
| D. | 漏斗下端紧靠烧杯内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥⑦ | B. | ①②④⑤⑥ | C. | ⑤⑦ | D. | ④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大O2浓度 | B. | 使用合适的催化剂 | ||
| C. | 减小压强 | D. | 降低温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com