
分析 根据M=ρVm计算该烃的含氧衍生物的摩尔质量,根据n=$\frac{m}{M}$计算8.8g该物质的物质的量,浓硫酸质量增加7.2g为燃烧生成水的质量,剩余气体过氢氧化钠溶液,溶液质量增加17.6g为燃烧生成二氧化碳的质量,根据n=$\frac{m}{M}$计算二氧化碳与是物质的量,根据质量守恒计算氧元素的质量,进而计算氧原子物质的量,据此确定有机物的分子式,该烃的含氧衍生物能与新制氢氧化铜反应,说明分子中含有-CHO,结合求该物质的分子式写出它的结构简式并命名.
解答 解:某烃的含氧衍生物,其蒸气在标准状况下的密度是1.96g/L,则其摩尔质量=1.96g/mol×22.4L/mol=44g/mol,8.8g该物质的物质的量=$\frac{8.8g}{44g/mol}$=0.2mol,
浓硫酸质量增加7.2g为燃烧生成水的质量,其物质的量为$\frac{7.2g}{18g/mol}$=0.4mol,故n(H)=0.8mol,
氢氧化钠溶液质量增加17.6g为燃烧生成二氧化碳的质量,其物质的量=$\frac{17.6g}{44g/mol}$=0.4mol,故n(C)=0.4mol,
故氧元素的质量=8.8g-0.8mol×1g/mol-0.4mol×12g/mol=3.2g,则n(O)=$\frac{3.2g}{16g/mol}$=0.2mol,
故该有机物分子中N(C)=$\frac{0.4mol}{0.2mol}$=2,N(H)=$\frac{0.8mol}{0.2mol}$=4,N(O)=$\frac{0.2mol}{0.2mol}$=1,
故该有机物的分子式为C2H4O,该烃的含氧衍生物能与新制氢氧化铜反应,说明分子中含有-CHO,则该物质的结构简式为CH3CHO,名称是乙醛,
答:该有机物的分子式为C2H4O,结构简式为CH3CHO,名称是乙醛.
点评 本题考查有机物分子式与结构的确定,为高频考点,侧重于学生的分析、计算能力的考查,难度不大,掌握燃烧法利用原子守恒确定有机物分子式的方法.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
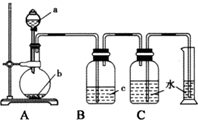 如图是制取、净化并测量生成气体体积的装置示意图.利用如图装置进行表所列实验,能达到实验目的是 ( )
如图是制取、净化并测量生成气体体积的装置示意图.利用如图装置进行表所列实验,能达到实验目的是 ( )| 选项 | a(液体) | b(固体) | c(液体) |
| A | 稀盐酸 | 锌粒 | 浓硫酸 |
| B | 浓氨水 | 生石灰 | 浓硫酸 |
| C | 饱和食盐水 | 电石 | 硫酸铜溶液 |
| D | 浓硫酸 | Cu片 | 氢氧化钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 Na2SO4 HCl | B. | NaOH NaCl HNO3 | ||
| C. | CuSO4 NaNO3 KOH | D. | Na2CO3 HCl Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
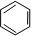 ;一种常见的烃的含氧衍生物:
;一种常见的烃的含氧衍生物: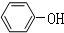 .
.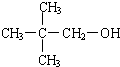 .
.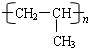 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家对石墨进行处理,使得石墨片的厚度逐渐减少,最终获得目前已知的最薄的材料--石墨烯(如图).下列关于石墨烯的说法正确的是( )
科学家对石墨进行处理,使得石墨片的厚度逐渐减少,最终获得目前已知的最薄的材料--石墨烯(如图).下列关于石墨烯的说法正确的是( )| A. | 石墨烯是一新型的纳米化合物 | B. | 石墨烯与C60互为同素异形体 | ||
| C. | 石墨烯是一种有机物 | D. | 石墨烯中碳元素的化合价为+3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.铁的冶炼 | B.电池放电 | C.天然气燃烧 | D.碳酸氢钠做发酵粉 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com