
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 100mL 0.1mol•L-1的稀硫酸中含有SO42-个数为0.1NA | |
| B. | 含1 mol HCl的盐酸溶液与足量Fe反应,Fe所失去的电子总数为2 NA | |
| C. | 4℃时,5.4mL水中所含的水分子数是0.3NA | |
| D. | 标准状况下,22.4L氢气所含的质子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
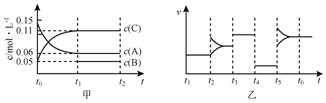
| A. | 若t1=15s,生成物C在t0~t1时间段的平均反应速率为0.004mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件为降低反应温度 | |
| C. | B的起始物质的量为0.02mol | |
| D. | t5~t6阶段容器内A的物质的量减少0.03mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为3A(g)?B(g)+2C(g)△H=-100akJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4溶液与稀硝酸反应:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| B. | 硫酸铝溶液中加入足量氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 碳酸氢铵和足量氢氧化钠溶液反应:NH4++OH-═NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①②④⑥ | C. | ①②③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:丁>丙>乙 | |
| B. | 单质的还原性:丁>丙 | |
| C. | 甲、乙、丙的氧化物均为共价化合物 | |
| D. | 乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①③ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 至少5个原子同在一条直线上 | B. | 所有的原子在一个平面上 | ||
| C. | 4个碳原子同在一条直线上 | D. | 4个氢原子不在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com