
(1)利用盖斯定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应。已知:N2(g)+ 2O2(g)="=" 2NO2(g) ΔH=" +67.7" kJ·mol-1,
N2H4(g)+ O2(g)="=" N2(g)+ 2H2O(g) ΔH=" -534" kJ·mol-1。
请写出气态肼与NO2气体完全反应生成氮气和水蒸气的热化学方程式: 。
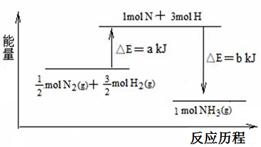
(2)已知:N≡N的键能是946kJ·mol-1,H—H的键能为436kJ·mol-1,N—H的键
能为393kJ·mol-1,计算合成氨反应生成1molNH3的△H= kJ·mol-1。
(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为________
②加水稀释100倍,所得溶液中由水电离出c(OH-)=____________
③与某浓度盐酸溶液按体积比(碱与酸之比)1 : 9混合后,所得溶液pH=11,该盐酸溶液的pH=________。
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=” 或“<” )。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+)
c(CH3COO-) .
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(1)2N2H4(g)+ 2NO2(g)= 3N2(g)+ 4H2O(g) ΔH=" -1135.7" kJ·mol-1 (2分)
(2)-52kJ·mol-1(2分)
(3)① 0.05mo1·L-1 (1分) ②1×10-11mo1/L(2分) ③ 2(2分)
(4)(1)碱性,>;(2分) (2)酸性,<;(2分) (3)中性,>; (2分)
解析试题分析:(1)根据盖斯定律:①N2H4(g)+ O2(g)="=" N2(g)+ 2H2O(g) ΔH=" -534" kJ·mol-1
②N2(g)+ 2O2(g)="=" 2NO2(g) ΔH=" +67.7" kJ·mol-1,
①×2-②:2N2H4(g)+ 2NO2(g)= 3N2(g)+ 4H2O(g) ΔH=" -1135.7" kJ·mol-1。
(2)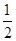 N2(g)+
N2(g)+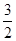 H2(g)
H2(g) NH3(g)的
NH3(g)的
△H=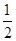 ×946kJ·mol-1+
×946kJ·mol-1+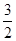 ×436kJ·mol-1-3×393kJ·mol-1=-52kJ·mol-1。
×436kJ·mol-1-3×393kJ·mol-1=-52kJ·mol-1。
(3)现有25℃、pH=13的Ba(OH)2溶液,c(H+)=10-13mol/L,c(OH-)=10-1mol/L,
①故Ba(OH)2溶液的物质的量浓度为0.05mol/L;
②加水稀释100倍,c(OH-)=10-3mol/L,这是Kw=c(OH-)·c(H+)水=10-14,溶液中由水电离出c(OH-)=c(H+)水=10-11mol/L。
③溶液pH=11,即c(OH-)=10-3mol/L,它与某浓度盐酸溶液按体积比(碱与酸之比)1 : 9混合:
1×10-1 mol/L -9×c(H+)HCl=10×10-3mol/L,c(H+)HCl=0.01mol/L,故该盐酸溶液的pH=2。
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后生成CH3COONa,其水解溶液呈碱性,溶液中c(Na+)>c(CH3COO-)。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合,CH3COOH已电离的与NaOH发生反应,醋酸仍继续电离使溶液呈酸性,溶液中c(Na+)<c(CH3COO-) .
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,根据电荷守恒可以推出c(OH-)=c(H+),则混合后溶液呈中性,由①可知,醋酸体积大于氢氧化钠溶液体积。
考点:综合考查盖斯定律、溶液的pH计算、NaOH溶液与CH3COOH溶液后的酸碱性判断等。


科目:高中化学 来源: 题型:单选题
将20g Ba(OH) ·8H
·8H O晶体与10 g NH
O晶体与10 g NH Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。则下列说法正确的是
Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。则下列说法正确的是
| A.实验中玻璃棒的作用是加速固体溶解 |
| B.玻璃片上结冰而与小烧杯粘在一起,说明该反应是放热反应 |
| C.所取反应物质量的多少会影响反应是吸热,还是放热 |
| D.该反应中,反应物的总能量小于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知反应A2(g)+B2(g)=2AB(g),断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2 kJ,生成1molAB中的化学键释放的能量为Q3kJ(Q1、Q2、Q3均大于零),则下列说法正确的是 ( )
| A.若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 |
| B.若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 |
| C.若该反应为放热反应,则Q1+Q2 < Q3 |
| D.若该反应为吸热反应,则Q1+Q2 < Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11 分)(原创)能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式
| | ① | H2(g)+ O2(g)= H2O(g) △H =﹣242kJ/mol; O2(g)= H2O(g) △H =﹣242kJ/mol; | ||||||||
| | ② | 2H2(g)+ O2(g)= 2H2O(l) △H =﹣572kJ/mol; | ||||||||
| | ③ | C(s)+ O2(g)= CO(g) △H =﹣110.5kJ/moL; O2(g)= CO(g) △H =﹣110.5kJ/moL; | ||||||||
| | ④ | C(s)+ O2(g)= CO2(g) △H =﹣393.5kJ/moL; | ||||||||
| | ⑤ | CO2(g)+ 2H2O(g)= CH4(g)+ 2O2(g)△H =" +" 802kJ/moL | ||||||||
| 化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H | | ||
| 键能kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 | | ||
 H2(g)+ CO(g)△H =" ___________" kJ/moL;
H2(g)+ CO(g)△H =" ___________" kJ/moL; 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
(1)人们常用催化剂来选择反应进行的方向。下左图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。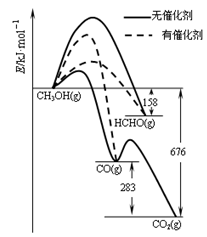
①在有催化剂作用下,CH3OH与O2 反应主要生成 (填“CO、CO2、HCHO”);
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H= 。
(2)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为 g。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。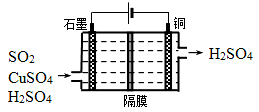
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1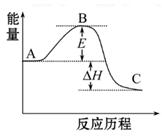
请回答下列问题:
(1)图中A、C分别表示_________、_________,E的大小对该反应的反应热有无影响?_________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是__________________;
(2)图中ΔH=_________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物VO2;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式_____________________________;
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3mol SO3(g)的ΔH_______(要求计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14 分) 一氧化碳被广泛应用于冶金工业和电子工业。
⑴高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) △H="a" kJ·mol-1
CO(g)+3Fe2O3(s)=CO2(g)+2Fe3O4(s) △H="b" kJ·mol-1
反应3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)的△H= kJ·mol-1(用含a、b 的代数式表示)。
⑵电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g) +CO(g) △H>0
CH3OH(g) +CO(g) △H>0
①第一步反应的机理可以用下图表示: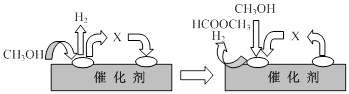
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。
⑶为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X—射线衍射谱图如图所示(X—射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为 。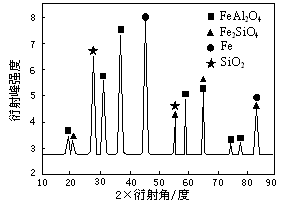
⑷某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2 g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43 ℃),并在180 ℃时使Ni(CO)4重新分解产生镍单质。
上述两步中消耗CO的物质的量之比为 。
⑸为安全起见,工业生产中需对空气中的CO进行监测。
①粉红色的PdCl2溶液可以检验空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀。每生成5.3gPd沉淀,反应转移电子数为 。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图所示。这种传感器利用原电池原理,则该电池的负极反应式为 。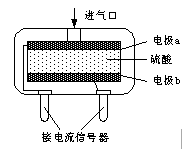
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1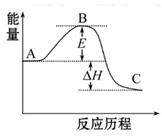
请回答下列问题:
(1)图中A、C分别表示_________、_________,E的大小对该反应的反应热有无影响?_________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是__________________;
(2)图中ΔH=_________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物VO2;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式_____________________________;
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3mol SO3(g)的ΔH_______(要求计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在化学反应中,反应物转化成生成物,必然发生能量的变化。
(1)下列说法正确的是 。
| A.化学变化中的能量变化主要由化学键变化引起的 |
| B.放热反应发生时不一定要加热,但吸热反应必须要加热才能发生 |
| C.钢铁的吸氧腐蚀和析氢腐蚀的负极反应都为Fe—2e一= Fe2+ |
| D.CaCO3(s) =" CaO(s)" + CO2(g) ΔH=" +" 178.5 KJ·mol-1的意义是表示1mol CaCO3完全分解生成1mol CaO和1mol CO2气体要放出178.5 KJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com