
| ||
| ||
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、12.0g熔融的NaHSO4中含有的阳离子数为0.1NA |
| B、常温下,5.6g Fe投入到足量浓硝酸中,转移电子数为0.3NA |
| C、2mol SO2和1mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA |
| D、足量的锌与一定量的浓硫酸反应生成1mol气体时,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 浓度(mol/L) | 时间(min) | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | 温 度 |
8000C | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 8000C | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 8000C | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
| 4 | 8200C | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
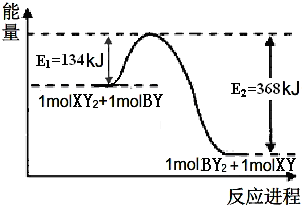 短周期元素A、B、X、Y、Z原子序数依次增大,A元素所处的周期数、主族序数、原子序数均相等,B的气态氢化物是天然气的主要成分,Y的最外层电子数是其内层电子数的3倍,Z单质可制成半导体材料,B、Z同主族.
短周期元素A、B、X、Y、Z原子序数依次增大,A元素所处的周期数、主族序数、原子序数均相等,B的气态氢化物是天然气的主要成分,Y的最外层电子数是其内层电子数的3倍,Z单质可制成半导体材料,B、Z同主族.查看答案和解析>>
科目:高中化学 来源: 题型:
 一种原电池的组成如图所示.试回答下列问题(灯泡功率合适):
一种原电池的组成如图所示.试回答下列问题(灯泡功率合适):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一种反应物 |
| B、催化剂 |
| C、起导热作用 |
| D、增大镁与水分子接触机会 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、130.4g?mol-1 |
| B、50.4g?mol-1 |
| C、182.4g?mol-1 |
| D、252g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钾与硫酸的反应 |
| B、锌与盐酸反应放出氢气 |
| C、碳还原氧化铜 |
| D、Ba(OH)2?8H2O与NH4Cl反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com