
| A. | 作净水剂的明矾和作消毒剂的漂白粉都是强电解质 | |
| B. | 浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 | |
| C. | 药皂中含有苯酚,能杀菌消毒,故苯酚具有强氧化性 | |
| D. | 合成氨生产中将NH3液化分离,虽可提高N2、H2的转化率但减小了反应速率 |
分析 A.漂白粉是混合物,电解质必须为化合物;
B.乙烯是一种植物生长调节剂,对水果蔬菜具有催熟的作用,乙烯能被酸性高锰酸钾氧化;
C.苯酚能够使蛋白质变性,但苯酚不具有强氧化性;
D.生成物浓度减小,反应速率减小.
解答 解:A.漂白粉属于混合物而不是纯净物,所以漂白粉不属于电解质,故A错误;
B.乙烯是一种植物生长调节剂,对水果蔬菜具有催熟的作用,为了延长水果的保鲜期,应除掉乙烯,乙烯能被酸性高锰酸钾氧化,所以将浸泡有酸性高锰酸钾溶液的硅藻土放置在盛放水果的容器中除去乙烯,故B错误;
C.苯酚的水溶液可使菌体蛋白变性杀菌消毒,但苯酚无强氧化性,故C错误;
D.合成氨生产中将NH3液化分离,导致生成物浓度减小,平衡向着正向移动,但反应速率会减小,故D正确;
故选D.
点评 本题考查较为综合,侧重于化学与生活、生产的考查,题目难度不大,试题有利于培养学生的良好的科学素养,提高学生学习的积极性,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 要使AlCl3溶液中Al3+全部沉淀出来可使用氨水 | |
| B. | 要检验某溶液中是否含Fe3+可加入铁粉 | |
| C. | 新制的氯水中可用PH试纸准确测定其PH值 | |
| D. | 某气体能使品红溶液褪色,该气体一定为SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
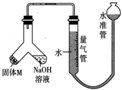 某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图所示装置进行实验.
某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
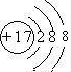 .
.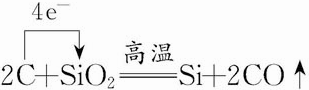 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 | B. | 4 | C. | 3 | D. | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
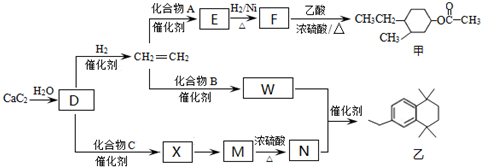
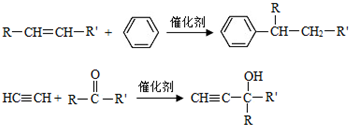 (-R、-R′代表烃基或-H)
(-R、-R′代表烃基或-H)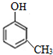 ,“E→F”的反应类型为加成反应.
,“E→F”的反应类型为加成反应. .
. .
.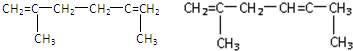 .
.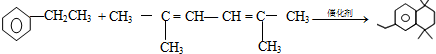 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-═4OH- | |
| B. | 常温下,NaHCO3溶液显碱性:HCO3-+H2O?CO32-+H3O+ | |
| C. | 氢氧化镁与稀硫酸反应:H++OH-═H2O | |
| D. | 硫酸亚铁酸性溶液中加入过氧化氢:Fe2++H2O2+2H+═Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
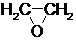 $→_{②}^{(CO,H_{2})/Co}$ HOCH2CH2CHO$→_{③}^{H_{2}/Ni}$ HOCH2CH2CH2OH
$→_{②}^{(CO,H_{2})/Co}$ HOCH2CH2CHO$→_{③}^{H_{2}/Ni}$ HOCH2CH2CH2OH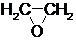 ,测得反应前和某一时刻气体的体积分数如下表.
,测得反应前和某一时刻气体的体积分数如下表.| C2H4 | O2 | N2 |  | |
| 反应前体积分数 | 25.0% | 15.0% | 60.0% | 0 |
| 某一时刻体积分数 | 5.56% | 5.54% | 66.7% | 22.2% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com