
下列实验装置图和相关操作正确的是
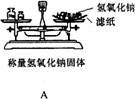
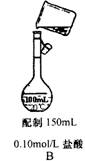
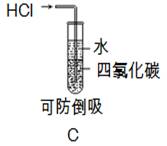

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:阅读理解
 (2011?武汉模拟)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(2011?武汉模拟)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:| 实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
| ④ | 1.2g | 无其他物质 | |
| ⑤ | 1.2g | CuO 0.5g | |
| ⑥ | 1.2g | MnO2 0.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
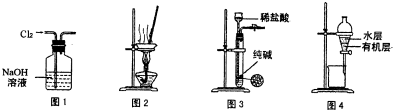
| A、用图1所示装置除去Cl2中含有的少量HCl | B、用图2所示装置蒸干NH4HCO3饱和溶液制备NH4HCO3晶体 | C、用图3所示装置制取少量纯净的CO2气体 | D、用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年云南省部分名校高三第一次联考(11月)理综化学试卷(解析版) 题型:实验题
高纯度单晶硅是典型的无机非金属材料,是制备半导体的重要材料,它的发现和使用曾引起计算机的一场“革命”。高纯硅通常用以下方法制备:用碳在高温下还原二氧化硅制得粗硅(含Fe、Al、B、P等杂质),粗硅与氯气反应生成四氯化硅(反应温度为450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置图。

相关信息:a.四氯化硅遇水极易水解;b.硼、铝、铁、磷在高温下均能与氯气直接化合生成相应的氯化物;c.有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
— |
315 |
— |
|
熔点/℃ |
-70.0 |
-107.2 |
— |
— |
— |
|
升华温度/℃ |
— |
— |
180 |
300 |
162 |
请回答下列问题:
(1)仪器e的名称为 ,装置A中f管的作用是 ,其中发生反应的离子方程式为 。
(2)装置B中的试剂是 。
(3)某学习小组设计了以下两种实验方案:方案甲:g接装置Ⅰ;方案乙:g接装置Ⅱ。但是甲乙两个方案中虚线内装置均有不足之处,请你评价后填写下表。
|
方案 |
不足之处 |
|
甲 |
|
|
乙 |
|
(4)在上述(3)的评价基础上,请设计一个合理方案: 。
(5)通过上述合理的装置制取并收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
查看答案和解析>>
科目:高中化学 来源:2014届甘肃省高三上学期期中考试理综化学试(解析版) 题型:实验题
高纯度单晶硅是典型的无机非金属材料,是制备半导体的重要材料,它的发现和使用曾引起计算机的一场“革命”。高纯硅通常用以下方法制备:用碳在高温下还原二氧化硅制得粗硅(含Fe、Al、B、P等杂质),粗硅与氯气反应生成四氯化硅(反应温度为450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置图。

相关信息:a.四氯化硅遇水极易水解;b.硼、铝、铁、磷在高温下均能与氯气直接化合生成相应的氯化物;c.有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
— |
315 |
— |
|
熔点/℃ |
-70.0 |
-107.2 |
— |
— |
— |
|
升华温度/℃ |
— |
— |
180 |
300 |
162 |
请回答下列问题:
(1)仪器e的名称为____________,装置A中f管的作用是_______________________________________,其中发生反应的离子方程式为_____ ____________________________________ _______。
(2)装置B中的试剂是____________。
(3)某学习小组设计了以下两种实验方案:方案甲:g接装置Ⅰ;方案乙:g接装置Ⅱ。但是甲乙两个方案中虚线内装置均有不足之处,请你评价后填写下表。
|
方案 |
不足之处 |
|
甲 |
|
|
乙 |
|
(4)在上述(3)的评价基础上,请设计一个合理方案:___________ ________ 。
(5)通过上述合理的装置制取并收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com