
硼砂(Na2B4O7)与NH4Cl共热,再用盐酸、热水处理,可得到白色固体氮化硼(BN)。
(1)配平方程式:________Na2B4O7+________NH4Cl===__________NaCl+__________B2O3+__________BN+________。
(2)BN是一种新型无机材料,它有两种结构,一种具有石墨结构,可作为润滑材料,它具有的性质是__________;一种具有金刚石结构,可作耐磨材料,它具有的性质是__________________________。
科目:高中化学 来源: 题型:
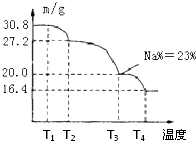 硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取.
硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取.查看答案和解析>>
科目:高中化学 来源:活题巧解巧练·高一化学(下) 题型:022
将硼砂(Na2B4O7)与NH4Cl一同加热,再用盐酸、热水处理,可制得白色固体氮化硼(BN).
(1)配平反应式:
□Na2B4O7+□NH4Cl □NaCl+□B2O3+□BN+□□
□NaCl+□B2O3+□BN+□□
(2)BN是一种新型的无机材料,它有两种结构,一种具有石墨型结构,可用作润滑材料,它具有的性质是________;一种具有金刚石型结构,可用作耐磨材料,它具有的性质是________.
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省龙岩市高三毕业班教学质量检查理综化学试卷(解析版) 题型:填空题
氯化硼(BN)晶体是一种新型无机合成材料。用硼砂(Na2B4O7)和尿素反应可以得到氮化硼:Na2B4O7+ 2CO(NH2)2=4BN+Na2O +4H2O+2CO2↑,根据要求回答下列问题:
(1)组成反应物的所有元素中,第一电离能最大的是___________________。
(2)尿素分子( )中
)中 键与
键与 键数目之比为__________;尿素分子中处于同一平面的原子最多有_______个。
键数目之比为__________;尿素分子中处于同一平面的原子最多有_______个。
(3)尿素分子一定条件下形成六角形“超分子”(结构如图)。“超分子”中尿素分子间主要通过什么作用力结合。答:________________(填1种)。

(4)图示“超分子”的纵轴方向有一“通道”。直链烷烃分子刚好能进人通道,并形成“超分子”的包台物;支链烷烃因含有测链,空间体积较大而无法进入“通道”。利用这一性质可以实现直链烷烃和支链烷烃的分离。
①直链烷烃分子能进人通道时,通过什么作用力与“超分子”结合,从而形成 “超分子”包合物?答:___________________。
②下列物质可以通过尿素“超分子”进行分离的是____________。
A.乙烷和丁烷??? B.丁烷和异丁烷??? C.异戊烷和新戊烷??? D氯化钠和氯化钾
(5)BN晶体有a、B两种类型,且a—BN结构与石墨相似、B—BN结构与金刚石相似。
①a一BN晶体中N原子杂化方式是____________________;
②B—BN晶体中,每个硼原予形成________个共价键。这些共价键中,有________个为配位键。
查看答案和解析>>
科目:高中化学 来源:期末题 题型:填空题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com