
(1)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。 现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
①该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是_______。
②写出一个包含上述七种物质的氧化还原反应方程式(不需配平) ___________。
③上述反应中,氧化剂是________,1 mol氧化剂在反应中________(填“得到”或“失去”)________mol电子。
④如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:___________________________________________________________________。
(2)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
①将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。
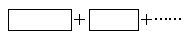
反应中,被还原的元素是________,氧化产物是______________。
②纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂的物质的量之比为________。
(3)一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗3.2 g CH3OH转移0.6 mol电子,则氧化产物为(填化学式),氧化产物与还原产物的物质的量之比是________。
(1)①KCl H2SO4
②KMnO4+KCl+H2SO4―→K2SO4+MnSO4+Cl2↑+H2O
③KMnO4 得到 5
④NaBiO3具有强氧化性(比KMnO4氧化性强)
(2)①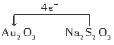 Au Na2S4O6 ②1∶4
Au Na2S4O6 ②1∶4
(3)CO2. 5:3
【解析】
试题分析:(1)将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,则反应物为HCl、KMnO4,且还原剂为HCl,氧化剂为KMnO4;则氧化还原反应的体系中,反应物和生成物共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4,反应物为KCl、H2SO4、KMnO4,且还原剂为HCl,氧化剂为KMnO4。
①该反应中Cl元素的化合价升高,H、S、O元素的化合价没有变化,则化合价升高的反应物为KCl,化合价没有发生变化的反应物为H2SO4。
②KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4中反应物为KCl、H2SO4、KMnO4,由电子守恒及质量守恒定律可知反应为2KMnO4+10KCl+8H2SO4═6K2SO4+2MnSO4+5Cl2↑+8H2O。
③该反应中的氧化剂为KMnO4,Mn元素的化合价由+7价降低为+2价,则1mol氧化剂在反应中得到1mol×(7-2)=5mol电子。
④如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,是因NaBiO3具有强氧化性(比KMnO4氧化性强),将Mn2+氧化为高锰酸根离子。
(2)①Au2O3为反应物,则反应中Au2O3→Au2O,Au的化合价由+3价变为+1价,化合价总共降低2×2=4价,Na2S4O6中硫元素平均化合价为+2.5,Na2S2O3中硫元素平均化合价为+2,所以Na2S2O3为反应物,Na2S4O6为生成物,故Na2S2O3转移4e-给Au2O3。被还原的元素是Au,氧化产物是Na2S4O6。
②反应中Na2S2O3→H2SO4,S硫元素平均化合价由+2价升高为+6价,Na2S2O3是还原剂,Cl2→NaCl、HCl,Cl元素化合价由0价降低为-1价,Cl2是氧化剂,根据电子转移相等,所以n(Na2S2O3)×2×(6-2)=n(Cl2)×2,故n(Na2S2O3):n(Cl2)=1:4
(3)3.2gCH3OH的物质的量为0.1mol,转移0.6mol电子时,化合价变化为6。所以氧化产物为CO2.根据HNO3→N2,由得失电子守恒,则参加反应的HNO3的物质的量为0.12mol,故氧化剂与还原剂的物质的量之比为:0.12:0.1=6:5。氧化产物与还原产物的物质的量之比是0.1:0.06=5:3。
考点:氧化还原反应的计算


 互动英语系列答案
互动英语系列答案科目:高中化学 来源:2016届甘肃省高一上学期期末考试化学试卷(解析版) 题型:选择题
下列反应中,硝酸既表现酸性,又表现氧化性的是( )。
A.Fe2O3跟稀硝酸反应 B.铜跟稀硝酸反应
C.CuO跟稀硝酸反应 D.Al(OH)3跟稀硝酸反应
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高一上学期期末考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合生成Na2CO3,Na2O2与CO2发生置换生成O2
③Na2O是淡黄色物质,Na2O2是白色物质
④Na2O2可作供氧剂,而Na2O不行
⑤Na2O2和Na2O焰色反应均为黄色
A、都正确 B、②③④⑤ C、②③⑤ D、④⑤
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高一上学期期中考试化学试卷(解析版) 题型:选择题
实验室用固态不纯氯化钠(含少量NH4HCO3和Na2SO4杂质)配制氯化钠溶液。下列操作可供选用:①逐滴加入稀盐酸,调节pH值为5;②煮沸;③加蒸馏水溶解;④加热至不再产生气体为止;⑤加入稍过量的Na2CO3溶液;⑥加入稍过量的BaCl2溶液;⑦过滤。上述实验操作的正确顺序应是( )
A.①②⑤⑥⑦③④ B.③④⑥⑤⑦①②
C.④③⑥⑤⑦①② D.④③⑤⑥⑦②①
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列有关化学实验操作中“先”与“后”的说法错误的是( )
A.高锰酸钾加热制备氧气,用排水法收集满氧气后,先撤酒精灯,后移出导管
B.给试管加热时,先给试管来回均匀加热,后固定局部加热
C.大量碱液流到桌子上,先用稀醋酸溶液中和,后用抹布抹去
D.点燃可燃性气体(如H2、CO、CH4等)时,先检验气体纯度,后点燃
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列离子方程式与所述事实相符且正确的是( )
A.Ca(OH)2悬浊液中滴加足量稀硝酸:H++OH-=H2O
B.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O
C.硫酸氢钠溶液中加入Ba(OH)2溶液至SO42-恰好完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
D.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列操作中,完全正确的一组是( )
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过1/3容积的试管加热
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤取用放在细口瓶中液体时,取下瓶塞倒放在桌面上,倾倒液体时,瓶上的标签对着地面
⑥将烧瓶放在桌上,用力塞紧塞子
⑦用坩埚钳夹取加热后的蒸发皿
⑧将胶头滴管垂直伸进试管内滴加液体
⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热
A.①④⑦⑩ B.①④⑤⑦⑩ C.①④⑦⑧⑩ D.④⑤⑦⑩
查看答案和解析>>
科目:高中化学 来源:2016届湖北省宜昌市协作体高一上学期期末化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.铝粉投入到NaOH溶液中:2Al+2OH-= 2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- = Al(OH)3↓
C.三氯化铁溶液中加入铁粉:
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源:2016届海南省三亚市高一上学期期中考试化学试卷(A)(解析版) 题型:计算题
将117 g NaCl溶于水配制成1 L溶液,回答下列问题:
(1)该溶液中NaCl的物质的量浓度为多少?
(2)配制1mol·L-1的NaCl溶液500mL,需要该溶液的体积为多少?
(3)向(2)所配制的溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3 mol·L- 1(假设溶液体积不变),则溶液中H+的物质的量浓度为多少?通入HCl气体的体积(标准状况下)为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com