
| A. | 食盐可作调味剂,也可以用作食品防腐剂 | |
| B. | 碳酸钾有一定的去污能力,在热水中去污能力会减弱 | |
| C. | 煤经过气化和液化等变化后,可以减少PM2.5引起的污染 | |
| D. | 根据纤维燃烧产生的气味,不能确定是否为蛋白质纤维 |
分析 A.食盐具有咸味,且能使细胞脱水;
B.热水促进碳酸钾水解,碱性增强;
C.煤气体生成CO和氢气,液化生成甲醇;
D.蛋白质灼烧有烧焦羽毛的气味.
解答 解:A.食盐具有咸味,且能使细胞脱水,则食盐可作调味剂,也可以用作食品防腐剂,故A正确;
B.热水促进碳酸钾水解,碱性增强,则在热水中去污能力会增强,故B错误;
C.煤气体生成CO和氢气,液化生成甲醇,转化为清洁能源,减少固体颗粒物的排放,可以减少PM2.5引起的污染,故C正确;
D.蛋白质灼烧有烧焦羽毛的气味,则根据纤维燃烧产生的气味,能确定是否为蛋白质纤维,故D错误;
故选AC.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、盐类水解、化石能源应用、性质与用途为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: | B. | N2的结构式:N≡N | C. | H2O的球棍模型: | D. | CH4的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 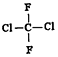 和 和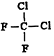 是两种不同的物质 是两种不同的物质 | |
| B. | 二氯甲烷属于正四面体的空间结构 | |
| C. | 己烷(C6H14)有5种同分异构体 | |
| D. | 新戊烷与2,2-二甲基丙烷的结构不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
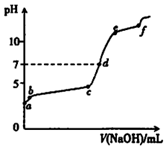 向0.1mol/L的Al2( SO4)3溶液中滴加1.0mol/L的NaOH溶液,滴加过程中溶液pH随NaOH溶液体积变化的曲线如图所示.下列分析不正确的是( )
向0.1mol/L的Al2( SO4)3溶液中滴加1.0mol/L的NaOH溶液,滴加过程中溶液pH随NaOH溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | a点pH<7的原因:Al3++3H2O?Al(OH)3+3H+ | |
| B. | bc段发生的主要反应:Al3++3OH-═Al(OH)3 | |
| C. | ef段发生的主要反应:Al(OH)3+OH-═AlO2-+2H2O | |
| D. | d点,溶液中大量存在的离子是Na+、AlO2-和SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
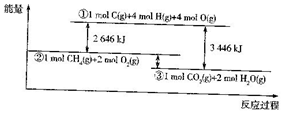 如图表示甲烷和氧气反应过程中的能量变化:请回答下列问题:
如图表示甲烷和氧气反应过程中的能量变化:请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
| A. | HClO的漂白性是因为酸性很弱 | |
| B. | 相同浓度的Na2CO3与NaHCO3溶液,后者的pH更大 | |
| C. | 反应 2C1O-+CO2+H2O=CO32-+2HClO可以发生 | |
| D. | 稀释醋酸溶液,则$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)}}$的数值随水量的增加而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 球棍模型: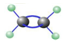 | B. | 分子中六个原子在同一平面上 | ||
| C. | 键角:109o28’ | D. | 碳碳双键中的一根键容易断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com