
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
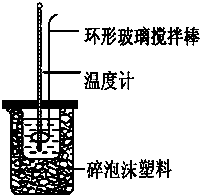
| 1.4212KJ×1mol |
| 0.025mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.用氢氧化钠溶液区别乙醇溶液和葡萄糖溶液 |
| B.用碳酸钠溶液区别乙酸和乙酸乙酯 |
| C.用金属钠区别无水乙醇和乙酸乙酯 |
| D.用溴水区别甲烷和乙烯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钠燃烧时发出黄色火焰 |
| B.在常温下,铝不能与氧气反应 |
| C.常温下可以用铁罐装运浓硫酸 |
| D.为了检验某FeCl2溶液是否变质,可向溶液中加入KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | ______ |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
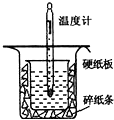
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
A.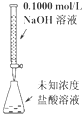 可以进行酸碱中和滴定实验 |
B.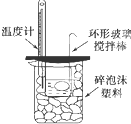 可以进行中和热的测定实验 |
C.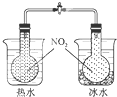 可验证温度对化学平衡的影响 |
D.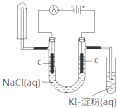 可检验食盐水通电后的部分产物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.石蕊、由蓝变红 | B.酚酞、红色褪去 |
| C.甲基橙,由橙变黄 | D.甲基橙、由黄变橙 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验数据(mL)/滴定次数 | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com