
 羰基铁[Fe(CO)5]会使合成甲醇和合成氨等生产过程中的催化剂中毒.
羰基铁[Fe(CO)5]会使合成甲醇和合成氨等生产过程中的催化剂中毒.分析 (1)Fe的原子序数为26,利用电子排布规律来书写铁原子的基态外围电子排布式;
(2)CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,则C、O之间为三键,等电子体中原子数和价电子数都相同;
(3)利用常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂来分析晶体类型;
(4)①离子的电荷相同时,离子半径越小,晶格能越大,熔沸点越大;②以体系为镁离子,六个面的面心为配位原子;③分解生成金属氧化物,利用氧化物的晶格能来分析;
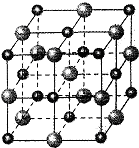
(5)Ni的堆积与MgO中氧原子堆积相同,晶胞中Ni为1+12×$\frac{1}{4}$=4,Ni可以吸附H2,氢以单个原子形式填入四面体空隙,则一个晶胞中有8个H.
解答 解:(1)Fe的原子序数为26,则基态电子排布式为[Ar]3d64s2,所以铁原子的基态外围电子排布式为3d64s2,
故答案为:3d64s2;
(2)CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为C≡O,孤对电子数为1,σ键数为1,则碳原子采取sp杂化,又等电子体中原子数和价电子数都相同,则 N2、CN-的原子数都是2,价电子数都是10,则互为等电子体,
故答案为:sp;N2;CN-;
(3)因常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,熔沸点低,构成微粒为分子,则Fe(CO)5晶体为分子晶体,
故答案为:分子晶体;
(4)①离子的电荷相同时,离子半径越小,晶格能越大,熔沸点越大,镁离子的半径小,则MgO的熔点高,
故答案为:高于;
②以体系为镁离子,六个面的面心为配位原子,则形成空间正八面体结构,
故答案为:正八面体;
③碳酸盐分解生成金属氧化物,因镁离子的半径比钙离子的半径小,则氧化镁的晶格能比氧化钙的晶格能大,所以MgCO3更易分解,
故答案为:镁离子结合碳酸根离子中的氧离子能力比钙离子强(氧化镁的晶格能比氧化钙大);
(5)Ni的堆积与MgO中氧原子堆积相同,O原子占据体心和棱心,晶胞中Ni为1+12×$\frac{1}{4}$=4,Ni可以吸附H2,氢以单个原子形式填入四面体空隙,由图可知有个个四面体,则一个晶胞中有8个H,所以Ni最大量吸收H2后,n(Ni):n(H)=4:8=1:2,
故答案为:1:2.
点评 本题考查物质结构有关知识,涉及核外电子排布、等电子体、晶胞的计算及晶体的性质,明确离子晶体中结构与性质的关系、离子的位置及空间结构式解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于Ksp(Ag2S)<Ksp(AgI),向含浓度分别为0.01mol/L的S2-与I-的混合溶液中加入足量的AgNO3(s),只有Ag2S沉淀生成 | |
| B. | FeS在水中的溶解度大于在Na2S溶液中的 | |
| C. | 向含有AgCl(s)的饱和AgCl溶液中加水,固体AgCl质量会减少,但AgCl的溶解度与Ksp均不变 | |
| D. | 达到沉淀溶解平衡时,溶液中离子浓度不一定相等但会保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
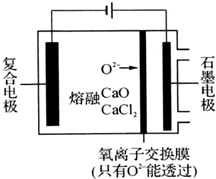 纳米二氧化钛作为一种新型的光催化剂,其用途相当广泛.金属钛具有优良的性能,是航天工业的重要材料.水解法制备纳米二氧化钛和电解钛的过程如下:
纳米二氧化钛作为一种新型的光催化剂,其用途相当广泛.金属钛具有优良的性能,是航天工业的重要材料.水解法制备纳米二氧化钛和电解钛的过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,该现象说明可用CCl4从碘水中萃取碘. | |
| B. | 向某水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明原溶液中一定含有SO42-离子 | |
| C. | 将饱和氯化铁溶液煮沸,可制得氢氧化铁胶体 | |
| D. | 稀释浓硫酸时将浓硫酸沿烧杯壁慢慢注入水中并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、Cu2+、Cl-、SO42- | D. | Na、H+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com