
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
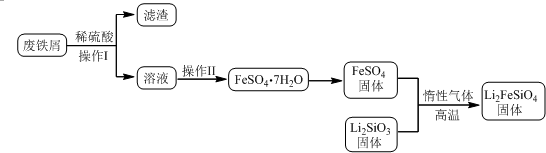
分析 实验(一)制备流程:废铁屑加入稀硫酸过滤得到溶液中通过蒸发浓缩,降温结晶,过滤洗涤得到FeSO4•7H2O,隔绝空气加热分解得到硫酸亚铁固体,和Li2SiO3反应得到Li2FeSiO4,
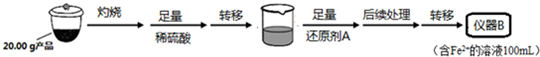
实验(二) Li2FeSiO4含量测定:取20.00g产品灼烧后加入足量稀硫酸溶解溶液转移到烧杯中,加入足量还原剂A可用SO2,还原铁离子为亚铁离子,
加热煮沸除去过量的SO2,以免影响后面Fe2+的测定,转移到仪器B为100ml容量瓶中配制得到准确体积和浓度的溶液,从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol•Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量.相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应,测定溶液体积,结合化学方程式定量关系计算,
(1)①操作Ⅱ是溶液中得到硫酸亚铁晶体的实验操作,蒸发浓缩,冷却结晶,过滤洗涤得到;
依据亚铁离子具有还原性分析;
(2)①实验二中仪器B为配制溶液需要的容量瓶,仪器C为滴定实验所用的标准溶液,标准溶液为高锰酸钾溶液具有氧化性需要盛放在酸式滴定管中;
②还原剂A可用SO2,二氧化硫具有还原性被铁离子氧化为硫酸,此时后续操作应除去过量的SO2;
③滴定实验反应终点的判断是依据高锰酸钾溶液滴入最后一滴溶液呈浅红色且半分钟不变化,依据反应定量关系和实验数据计算产品中Li2FeSiO4的质量分数,滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,会造成V(标准)偏大,会造成c(待测)偏高;
解答 解:(1)①操作Ⅱ是溶液中得到硫酸亚铁晶体的实验操作,蒸发浓缩,降温结晶,过滤洗涤得到,
故答案为:蒸发浓缩,降温结晶,过滤;
②固相法中制备Li2FeSiO4的过程必须在惰性气体氛围中进行,因为亚铁离子具有还原性,易被氧化,所以惰性气体氛围中是为了防止亚铁离子被氧化,
故答案为:防止二价铁被氧化;
(2)①实验二中仪器B为配制溶液需要的容量瓶,得到含Fe2+离子的溶液100ml,需要仪器为100ml容量瓶,仪器C中为滴定实验所用的标准溶液,标准溶液为高锰酸钾溶液具有氧化性能腐蚀橡胶管,需要盛放在酸式滴定管中,名称为酸式滴定管,
故答案为:酸式滴定管;
②还原剂A可用SO2,二氧化硫具有还原性被铁离子氧化为硫酸,反应的离子方程式为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,此时后续操作应除去过量的SO2以免影响后面Fe2+的测定,
故答案为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+;除去过量的SO2,以免影响后面Fe2+的测定;
③滴定实验反应终点的判断是依据高锰酸钾溶液滴入最后一滴溶液呈浅红色且半分钟不变化,从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol•Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量.相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应.消耗高锰酸钾溶液体积第3次误差较大舍去,计算平均消耗溶液体积,结合离子反应的定量关系计算,V(标准)=$\frac{20.00+19.98+20.02}{3}$ml=20.00ml,铁元素守恒计算
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
5Li2FeSiO4~5Fe2+~MnO4-,
5 1
n 0.2000mol/L×0.020L
n=0.0200mol
100ml溶液中含物质的量=0.0200mol×$\frac{100}{20}$=0.1000mol,
产品中Li2FeSiO4的质量分数=$\frac{0.1mol×162g/mol}{20.00g}$×100%=81.00%,
滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,会造成V(标准)偏大,会造成c(待测)偏高,
故答案为:溶液变为浅红色,且半分钟内不变色;81.00%;偏高;
点评 本题考查了物质制备、物质含量测定和滴定实验过程的分析应用,注意实验基本操作的理解应用,掌握基础是解题关键,题目难度中等.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,平衡时若充入稀有气体,SO2的转化率增大 | |
| B. | 0~6 min的平衡反应速率:v(O2)=0.105 mol/(L•min) | |
| C. | 保持其他条件不变,仅降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| D. | 反应开始时,向容器中通入的SO2的物质的量是1.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g);△H
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g);△H查看答案和解析>>
科目:高中化学 来源: 题型:解答题
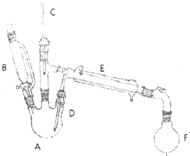 溴乙烷是有机合成的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:
溴乙烷是有机合成的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸(H2SO4) | 98 | 1.84 | 338.0 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然植物油常温下一般呈液态,难溶于水,没有恒定的熔点、沸点 | |
| B. | 乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应 | |
| C. | 乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com