
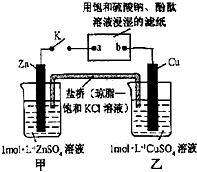
| A. | Cu电极上发生还原反应 | B. | 电子沿Zn→a→b→Cu路径流动 | ||
| C. | 片刻后甲池中c(SO42-)增大 | D. | 片刻后可观察到滤纸b点变红色 |
分析 甲、乙装置能自发的进行氧化还原反应,所以是原电池,锌易失电子作负极,铜作正极,则含有硫酸钠溶液的滤纸是电解池,a是阴极,b是阳极,阴极上氢离子放电,阳极上氢氧根离子放电,电子从负极沿导线流向电解池阴极,原电池放电时,阴离子向负极移动,阳离子向正极移动.
解答 解:甲、乙装置能自发的进行氧化还原反应,所以是原电池,锌易失电子作负极,铜作正极,则含有硫酸钾溶液的滤纸是电解池,a是阴极,b是阳极,
A.铜电极上铜离子得电子发生还原反应而生成铜,故A正确;
B.电子从Zn→a,b→Cu路径流动,电子不进入电解质溶液,故B错误;
C.锌作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,硫酸根离子不参加反应,所以硫酸根离子浓度不变,故C错误;
D.电解池中,a电极上氢离子放电生成氢气,同时a电极附近生成氢氧根离子,导致溶液碱性增强,所以a极变红色,故D错误;
故选A.
点评 本题考查了原电池和电解池原理,明确各个电极上发生的电极反应是解本题关键,易错选项是B,注意电子不进入电解质溶液,电解质溶液是通过阴阳离子的定向移动形成电流,为易错点.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | v ( N2)=0.2mol/(L•min) | B. | v ( N2)=0.1mol/(L•min) | ||
| C. | v ( NH3)=0.1mol/(L•min) | D. | v (H2)=0.3mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 63.8 g | B. | 53.6 g | C. | 46.8 g | D. | 43.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
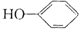 合成
合成 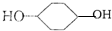
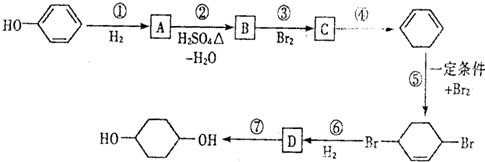
 ,D
,D .
.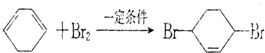 写出在同样条件下CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学反应方程式
写出在同样条件下CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学反应方程式 .
.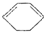 的反应方程式(有机物写结构简式,注明反应条件).
的反应方程式(有机物写结构简式,注明反应条件). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①② | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL1mol•L-1的NaCl溶液 | B. | 75mL4mol•L-1的NH4Cl溶液 | ||
| C. | 75mL1mol•L-1的FeCl3溶液 | D. | 150mL2mol•L-1的KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
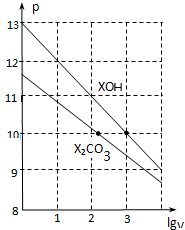
| A. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| B. | 已知常温下,0.1 mol•L-1 XHCO3溶液的pH=8.31,则Ka1(H2CO3)•Ka2(H2CO3)>Kw | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
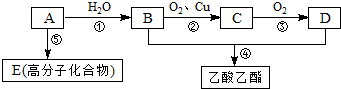
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com