
| A. | 放电时储氢合金作正极 | |
| B. | 充电时储氢合金作负极 | |
| C. | 充电时阳极周围c(OH-)减少 | |
| D. | 放电时负极反应为LaNi5H6-6e-═LaNi5+6H+ |
分析 此电池放电时的反应为LaNi5H6+6NiO(OH)═LaNi5+6Ni(OH)2,正极反应为6NiOOH+6e-=6Ni(OH)2+6OH-,负极反应为LaNi5H6-6e-+6OH-=LaNi5+6H2O.由此可见储氢合金是还原剂,作原电池的负极.充电时的总反应为LaNi5+6Ni(OH)2=LaNi5H6+6NiOOH,阳极反应为6Ni(OH)2+6OH--6e-=6NiOOH+6H2O,阴极反应为LaNi5+6H2O+6e-=LaNi5H6+6OH-.
解答 解:此电池放电时的反应为LaNi5H6+6NiO(OH)═LaNi5+6Ni(OH)2,正极反应为6H2O+6NiO(OH)+6e-=6Ni(OH)2+6OH-,负极反应为 LaNi5H6-6e-+6OH-=LaNi5+6H2O.由此可见储氢合金是还原剂,作原电池的负极.充电时的总反应为LaNi5+6Ni(OH)2=LaNi5H6+6NiOOH,阳极反应为6Ni(OH)2+6OH--6e-=6NiOOH+6H2O,阴极反应为LaNi5+6H2O+6e-=LaNi5H6+6OH-.
A、放电时是原电池,依据总反应化学方程式可知,储氢合金做电池的负极,故A错误;
B、充电时,储氢合金失电子发生氧化反应,作阴极,故B错误;
C、充电时电解池,阳极电极反应为:6Ni(OH)2+6OH-+6e-=6NiOOH+6H2O,氢氧根离子浓度减小,故C正确;
D、放电时,负极失电子发生氧化反应,电极反应为:LaNi5H6+6OH--6e-=LaNi5+6H2O,故D错误;
故选A.
点评 本题考查原电池、电解池原理的理解和应用,主要是应用题干信息和知识迁移应用能力等问题的考查,书写电极反应是关键.


科目:高中化学 来源: 题型:解答题
 绿矾是一种重要的化工原料.
绿矾是一种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液:Na+、Ca2+、SO42-、CO32- | |
| B. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| C. | 氯水溶液:H+、Fe2+、SO42-、Cl- | |
| D. | 含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
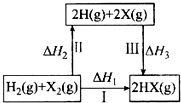
| A. | H2 (g)+X2(g)═2H(g)+2X(g)△H2<0 | |
| B. | 生成HX的反应热与途径有关,所以△H1≠△H2+△H3 | |
| C. | 若X分别表示Cl,Br,I,则过程Ⅱ吸收的热量依次增多 | |
| D. | Cl2,Br2分别发生反应I,同一温度下的平衡常数分别为K1,K2,则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
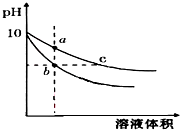 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH 随溶液体积变化的曲线如图所示,则下列叙述不正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH 随溶液体积变化的曲线如图所示,则下列叙述不正确的是( )| A. | b、c两点溶液的导电能力不相同 | |
| B. | a、b、c三点溶液中水的电离程度a>c>b | |
| C. | 用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vb=Vc | |
| D. | c点溶液中C(H+)+C(CH3COOH)=C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
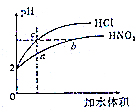 室温下,体积和pH都相同的盐酸和HNO2溶液加水稀释时的pH变化曲线如图所示,下列有关说法正确的是( )
室温下,体积和pH都相同的盐酸和HNO2溶液加水稀释时的pH变化曲线如图所示,下列有关说法正确的是( )| A. | 原HNO2溶液的浓度为0.01mol•L-1 | |
| B. | 溶液中水的电离程度:b>c | |
| C. | $\frac{c(N{{O}_{2}}^{-})}{c(HN{O}_{2})•c(O{H}^{-})}$比值:b>a | |
| D. | 等浓度的HNO2与NaOH溶液按体积比为2:1充分反应的混合液中,c(NO2-)+2c(OH-)=c(HNO2)+2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往紫色石蕊试液中加入盐酸,溶液变红 | |
| B. | 饱和FeCl3溶液在沸水中变成红褐色胶体 | |
| C. | 向FeSO4溶液中滴加NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色 | |
| D. | SO2使滴有酚酞的NaOH溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com