
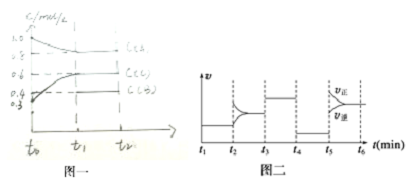
| A. | t4-t5阶段改变的条件为减小压强 | |
| B. | B的起始物质的量为1.0 mol | |
| C. | 在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡(与t1时刻浓度相同),a、b、c要满足的条件为a+$\frac{2c}{3}$=2.4和b+$\frac{c}{3}$=1.2 | |
| D. | 此温度下该反应的化学方程式为2A(g)+B(g)?2C(g) |
分析 t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,如t4~t5阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应速率不相等,则t4~t5阶段应为减小压强,即该反应为气体体积不变的反应;反应中A的浓度变化为1mol/L-0.8mol/L=0.2mol/L,C的浓度变化为0.6mol/L-0.3mol/L=0.3mol/L,则A、C的化学计量数之比为2:3,又该反应为气体体积不变的反应,则B为反应物,该反应为2A(g)+B(g)?3C(g),以此来解答.
解答 解:t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,如t4~t5阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应速率不相等,则t4~t5阶段应为减小压强,即该反应为气体体积不变的反应;反应中A的浓度变化为1mol/L-0.8mol/L=0.2mol/L,C的浓度变化为0.6mol/L-0.3mol/L=0.3mol/L,则A、C的化学计量数之比为2:3,又该反应为气体体积不变的反应,则B为反应物,该反应为2A(g)+B(g)?3C(g),
A.t4-t5阶段改变的条件为减小压强,该反应为气体体积不变的反应,所以平衡不移动,故A正确;
B.A减少0.2mol/L,则B减少0.1mol/L,则起始B的浓度为0.1mol/L+0.4mol/L=0.5mol/L,起始物质的量为0.5mol/L×2L=1mol,故B正确;
C.相同条件下,达到同样的平衡状态,则起始量相同即可,则极转化后满足的条件为a+$\frac{2c}{3}$=2.4和b+$\frac{c}{3}$=1.2,故C正确;
D.由上述分析可知,此温度下该反应的化学方程式为2A(g)+B(g)?3C(g),故D错误;
故选D.
点评 本题考查化学平衡移动图象题,注意从图二判断各阶段的影响因素,此为解答该题的关键,易错点为C中等效平衡的分析,侧重学生分析能力及计算能力的考查,题目难度不大.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题
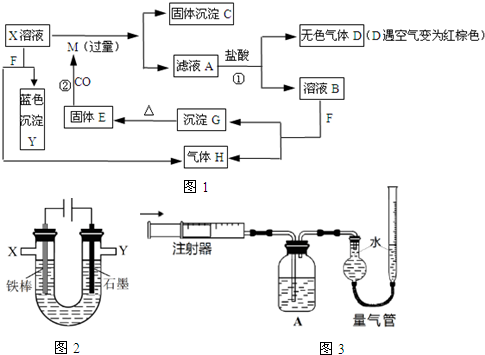
 ;G的化学式为Fe(OH)3.
;G的化学式为Fe(OH)3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  +HNO3$→_{△}^{浓盐酸}$ +HNO3$→_{△}^{浓盐酸}$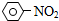 +H2O 取代反应 +H2O 取代反应 | |
| B. | CH2=CH2+Br2→CH2Br CH2Br; 加成反应 | |
| C. | CH3CH2OH+HCl→CH3CH2Cl+H2O; 酯化反应 | |
| D. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$ 2CH3CHO+2H2O; 氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列有关木糖醇的叙述中不正确的是( )
,下列有关木糖醇的叙述中不正确的是( )| A. | 1mol木糖醇与足量钠反应最多可产生2.5molH2 | |
| B. | 木糖醇是一种单糖,不能发生水解反应 | |
| C. | 木糖醇易溶解于水,能发生酯化反应 | |
| D. | 糖尿病患者可以食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为铜,丁为氯化亚铁,则乙一定是氯化铁 | |
| B. | 若甲为碳,丁为硅,则丙一定是二氧化碳 | |
| C. | 若甲为铝,丁为铁,则乙一定是氧化铁 | |
| D. | 若甲为镁,丁为氢气,则乙一定是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据一次能源和二次能源的划分,氢气为二次能源 | |
| B. | 电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源 | |
| C. | 火电是将燃料中的化学能直接转化为电能的过程 | |
| D. | 原电池工作过程中是直接将化学能转化为电能的过程 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高二上期中化学试卷(解析版) 题型:选择题
常温时向一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积之比是( )
A.1:9 B.1:1 C.1:2 D.1:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com