
【题目】60年代美国化学家鲍林提出了一个经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基氧原子数,鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)的关系见下表.
m-n | 0 | 1 | 2 | 3 |
含氧酸强度 | 弱酸 | 中强 | 强 | 很强 |
实例 | HClO | H3PO4 | HNO3 | HClO4 |
试回答下列问题:
(1)按此规则判断碳酸应属于_____酸。
(2)按此规则判断H3AsO4、H2CrO4、HMnO4酸性由弱到强的顺序为_______________。
(3)H3PO3和H3AsO3的形式一样,但酸性强弱相差很大.已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构__________________、________________________。
【答案】 中强酸 H3AsO4<H2CrO4<HMnO4 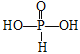
![]()
【解析】(1)碳酸中m-n=1,按此规则碳酸应属于中强酸。
(2)H3AsO4、H2CrO4、HMnO4中的m-n依次为1、2、3,按此规则,依次为中强酸、强酸、很强酸。
(3)H3PO3为中强酸,H3PO3中含1个非羟基氧原子,P原子最外层有5个电子,H3PO3的分子结构为 ;H3AsO3为弱酸,H3AsO3中不含非羟基氧原子,As原子最外层有5个电子,根据价键规则,H3AsO3的分子结构为
;H3AsO3为弱酸,H3AsO3中不含非羟基氧原子,As原子最外层有5个电子,根据价键规则,H3AsO3的分子结构为![]() 。
。
(1)碳酸的分子式为H2CO3,其中m-n=1,按此规则碳酸应属于中强酸。
(2)H3AsO4、H2CrO4、HMnO4中的m-n依次为1、2、3,按此规则,依次为中强酸、强酸、很强酸,酸性由弱到强的顺序为H3AsO4![]() H2CrO4
H2CrO4![]() HMnO4。
HMnO4。
(3)H3PO3为中强酸,H3PO3中含1个非羟基氧原子,P原子最外层有5个电子,H3PO3的分子结构为 ;H3AsO3为弱酸,H3AsO3中不含非羟基氧原子,As原子最外层有5个电子,根据价键规则,H3AsO3的分子结构为
;H3AsO3为弱酸,H3AsO3中不含非羟基氧原子,As原子最外层有5个电子,根据价键规则,H3AsO3的分子结构为![]() 。
。


科目:高中化学 来源: 题型:
【题目】理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)画出原电池装置图_______,该电池的负极发生_______反应(填“氧化”或“还原”),电解质溶液是_______;
(2)放电时银离子向__________(填“正极”或“负极”),正极上出现的现象是________。
(3)当反应进行一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移了电子数目是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的应用正确的是( )
A.常温下干燥氯气与铁不反应,可以用钢瓶储存氯水
B.次氯酸钠具有强氧化性,可用于配制消毒液
C.“84”消毒液与“洁厕灵”混合使用,去污效果更好
D.液氯有酸性,氯水有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,装置如图所示,其中Y为CO2。下列说法不合理的是( )
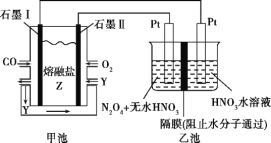
A. 石墨Ⅰ是原电池的负极,发生氧化反应
B. 甲池中的CO32-向石墨Ⅱ极移动
C. 乙池中左端Pt极电极反应式:N2O4-2e-+2HNO3![]() 2N2O5+2H+
2N2O5+2H+
D. 若甲池消耗标准状况下的氧气2.24 L,则乙池中产生氢气0.05 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向稀醋酸溶液中加入少量醋酸钠固体,醋酸的电离程度增大
B. 电镀时,通常把待镀金属制品作阴极,镀层金属作阳极
C. 常温下,2NO2(g)=2NO(g)+O2(g)不能自发进行,则该反应的△H>0
D. 工业通过反应“Na(l)+KCl(l) ![]() NaCl(l)+K(g)”冶炼钾,说明钠的金属性强于钾
NaCl(l)+K(g)”冶炼钾,说明钠的金属性强于钾
查看答案和解析>>
科目:高中化学 来源: 题型:
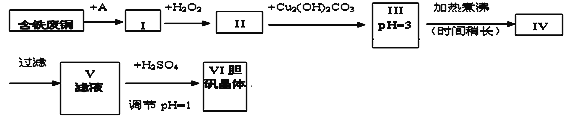
【题目】胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
pH值控制可参考下列数据
物 质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
氢氧化铁 | 2.7 | 3.7 |
氢氧化亚铁 | 7.6 | 9.6 |
氢氧化铜 | 5.2 | 6.4 |
请根据上述流程回答下列问题:
(1)A物质可选用_____(填字母)。
a.稀H2SO4 b.浓H2SO4/△ c.浓FeCl3溶液 d.浓HNO3
(2)I中加H2O2的离子方程式________________________________________。
(3)II中加Cu2(OH)2CO3的目的是________________________;其优点是__________。
(4)III加热煮沸时发生的化学反应的离子方程式为________________________。
(5)V中加H2SO4调节pH=1是为了____________________________________________。
(6)V到VI的操作是_________________________________
(7)某同学认为上述流程中所加的A物质并不理想,需作改进,其理由是__________。如何改进___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于NaCl的下列叙述正确的是( )
A. 表示一个氯化钠分子 B. 在氯化钠中存在钠原子和氯原子
C. Na+与Cl-的结构示意图相同 D. Na+与Cl-之间存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用干海带浸取原液制取纯碘主要包含的步骤有:①通氯气氧化、②用CCl4萃取分液、③在CCl4相中加入NaOH溶液反萃取(转化为NaI和NaIO3)并分液、④水相用硫酸酸化分离出粗碘、
⑤干燥后加适量KI固体(将IBr和ICl转化为I2、KBr及KCl)混匀加热得纯碘等。选择下列装置进行实验:
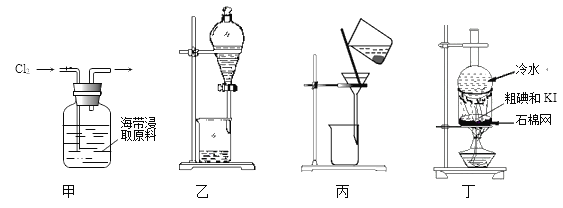
下列说法错误的是
A. 步骤①可用甲装置氧化I-
B. 步骤②、③分液操作时可用乙装置:先放出有机相,再放出水相
C. 步骤④可用丙装置将碘与母液分离
D. 步骤⑤可用丁装置升华法提纯碘
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com